Gli sport di resistenza sono classificati come attività fisica continua di durata superiore a 30 min. Le attività di durata superiori a 4-5 h sono considerate ultra-endurance (Saris et al. 2003). Si basano sulla risintesi dipendente dall’ossigeno dell’adenosina trifosfato (ATP), che richiede sia un’adeguato apporto di ossigeno ai mitocondri, sia la disponibilità di carboidrati (CHO) e combustibili lipidici (Joyner & Coyle, 2008). Il successo competitivo va agli atleti che mantengono le massime prestazioni/velocità per tutta la durata della loro prestazione. In effetti il ritmo di gara in molti eventi di resistenza (ad esempio, la maratona o lo sci di fondo) comporta una percentuale molto elevata della massima intensità aerobica di un individuo (Joyner et al. 2011; Tucker, 2016; Burke et al.2019 ). In attività o eventi più lunghi non basati su un’unica prestazione (ad es. Ironman, gare ciclistiche su strada a tappe), le caratteristiche tattiche, del terreno e della stimolazione richiedono fasi a velocità superiore o inferiore (Fernandez-Garcia et al. 2000; Bentley et al. 2002; Tucker, 2016). Anche quando tali fasi di gara (ad es. fasi intermedie, salite, pendenze, sprint finale) apportano un contributo ai costi energetici complessivi, risultano fondamentali per il risultato dell’evento. Le caratteristiche chiave degli atleti di resistenza d’élite, maturate attraverso la genetica e l’allenamento, implicano l’interazione di un’alta capacità aerobica di picco (VO2 di picco), elevata capacità ossidativa muscolare ed elevata economia del gesto esercizio-correlato (Joyner & Coyle, 2008). Le strategie di allenamento e nutrizione mirano a garantire un’adeguata disponibilità e capacità d’integrare l’uso delle riserve di carburante del muscolo per produrre ATP in base alle esigenze dell’evento; un concetto che sta diventando noto come “flessibilità metabolica”.
Introduzione
Negli ultimi 60 anni, le linee guida nutrizionali per gli sport di resistenza si sono concentrate su strategie per uguagliare le riserve finite del corpo di CHO ai costi in termini di spesa energetica dell’attività (Burke et al.2018), usando l’integrazione di CHO per ottimizzare il contenuto di glicogeno muscolare e/o l’assunzione di CHO durante l’attività per sostenere l’elevata disponibilità di CHO per le competizioni di lunga durata. Questi approcci migliorano le prestazioni di resistenza quando sostengono alti tassi di ossidazione di CHO durante l’esercizio (Hawley et al. 1997; Stellingwerff & Cox, 2014) e supportano il reclutamento motorio, la stimolazione e la percezione dello sforzo (Burke & Maughan, 2015). Sono stati osservati chiari benefici per le prestazioni degli atleti d’élite in situazioni sia di studio di ricerca, che sul campo (Hyman, 1970; Pfeiffer et al. 2012; Burke et al. 2017).
Le diete a basso contenuto di CHO e alto contenuto di grassi (LCHF) aumentano il rilascio, il trasporto, l’assorbimento e l’utilizzo del grasso nei muscoli, anche negli atleti di resistenza, il cui allenamento, va a migliorare tali adattamenti (Spriet, 2014). Le strategie esplorate negli ultimi 40 anni includono la pratica di modelli non chetogeni (Lambert et al. 1994; Goedecke et al. 1999) e modelli che inducono la chetosi, cosiddette “chetogeniche”, le diete LCHF (Phinney et al. 1983). È stata anche studiata la disponibilità periodica elevata di CHO a seguito di adattamento a breve termine a un LCHF non chetogenico (Burke et al. 2000; Carey et al. 2001, 2002; Havemann et al. 2006). Dal 2012 sia la letteratura scientifica, che quella non scientifica hanno esaminato i benefici della dieta chetogenica a basso contenuto di CHO e alto contenuto di grassi (K-LCHF) sulle prestazioni di resistenza (Noakes et al. 2014; Volek et al. 2015). Sebbene siano state attribuite a questa dieta una serie di modifiche metaboliche (Volek et al. 2015), i vantaggi proposti per le prestazioni di resistenza sono la massimizzazione dei tassi di ossidazione dei grassi (> 1,0 g min-1, con tassi di picco di ossidazione dei grassi che si spostano da circa il 45% al 70% della capacità aerobica) e aumento della produzione epatica di corpi chetonici (‘chetoni’) per fornire un substrato aggiuntivo per il muscolo (Volek et al. 2015; Shaw et al.2019) e il sistema nervoso centrale (SNC) ( Volek et al.2015). Le diete K-LCHF sono associate ad aumenti sostenuti (>0,5 mmol/l) di chetoni plasmatici (β‐idrossibutirrato; β-HB) (Volek et al.2015; Shaw et al.2019).
Dunque tale dieta è “il futuro degli sports di resistenza d’élite?
Lo studio da qui ho tratto questo testo pone l’accento su tre questioni:
- I tassi massimi di ossidazione dei grassi vengono ottenuti dal trasferimento di K-LCHF verso benefici in termini di prestazioni nello sport di resistenza ?
- Quale è l’andamento nel tempo del “keto-adattamento”?
- Le strategie che periodizzano K-LCHF con elevata disponibilità di CHO potrebbero fornire vantaggi alternativi sulle prestazioni?
Questi temi estendono i precedenti riassunti (Burke, 2015; McSwiney et al.2019; Shaw et al. 2020) e affrontano ipotesi entusiastiche e testimonianze circa il K-LCHF nello sport, in un momento in cui c’è un riflettore su barriere prestazionali come ile 2 ore nella maratona (Burke et al.2019; Hoogkamer et al.2019) e l’aumentato interesse per i benefici dell’allenamento con scarsa integrazione di carboidrati (Burke et al.2018).
È necessario avere una panoramica delle definizioni e spiegazioni uniformi di gestioni acute e croniche di grasso e CHO nella dieta dell’atleta per evitare di farsi idee sbagliate sulla dieta K‐LCHF (Burke et al.2018). La tabella 1 riassume le varie filosofie dietetiche riguardanti CHO, con un range che va dal raggiungimento dell’elevata disponibilità di CHO (HCHO) in tutte le sessioni (per ottimizzare la capacità di allenamento o le prestazioni dell’attività) alla restrizione di CHO cronica (per sostenere la dipendenza dall’uso di grasso muscolare). Un approccio ibrido all’allenamento nutrizionale, popolarmente noto come disponibilità periodica di CHO, integra delle sessioni con HCHO ad altre con bassa integrazione CHO in base alle caratteristiche dell’allenamento e agli obiettivi generali dell’atleta (Marquet et al. 2016; Burke et al. 2017). Tali strategie di “allenamento basso” sono acute e applicate in modo intermittente (ovvero 1-2 sessioni alla volta), attraverso una limitazione a breve termine di CHO, piuttosto che un consumo elevato di grassi (Mirtschin et al.2018). Pur condividendo l’obiettivo di una maggiore capacità ossidativa muscolare attraverso una migliore biogenesi mitocondriale (Impey et al.2018), l’esecuzione e altri risultati di questo approccio dietetico differiscono da quelli di LCHF e non devono essere mischiati e confusi (Burke et al.2018). Mentre la dieta K-LCHF viene proposta come strategia cronica di allenamento/competizione che massimizza il grasso come combustibile per gli esercizi fisici, i modelli alternativi vanno dal periodizzare un mesociclo (di circa 3-4 settimane) della dieta K-LCHF all’interno di un piano di allenamento HCHO a lungo termine, all’integrazione di sessioni occasionali e specifiche di HCHO all’interno di una dieta cronica K-LCHF. Le strategie ibride per l’alimentazione da competizione per l’atleta keto-adattato comportano l’aggiunta di strategie che promuovono un’elevata disponibilità di CHO prima e durante l’attività, con particolare attenzione al ripristino della disponibilità di CHO endogena e/o esogena.
Le prove iniziali
L’interesse per il K-LCHF e lo sport di resistenza è emerso da uno studio del 1983 di Phinney e altri, modellato sulle diete osservate tra le tribù Inuit (Volek et al. 2015). Cinque ciclisti ben allenati pedalarono fino ad esaurimento a circa il 63% del VO2 di picco, dopo aver consumato due diete in condizioni di salute metabolica: 1 settimana di assunzione abituale di CHO (circa 57% del carico energetico), quindi 4 settimane di adattamento fortemente ristretta verso i CHO (<20 g/giorno di CHO e l’80% di energia sotto forma di grasso). Nonostante una riduzione di circa il 50% delle concentrazioni di glicogeno muscolare con K-LCHF, la capacità di esercizio non è diminuita in base alle credenze prevalenti sull’importanza della disponibilità di glicogeno (Hawley et al. 1997), ma è stata supportata da un sostanziale aumento dell’ossidazione del grasso muscolare (tabella 2). La scoperta chiave della resistenza mantenuta, tuttavia, ha mascherato una risposta altamente variabile al trattamento con K-LCHF, con la media del gruppo distorta da un sostanziale aumento della capacità di esercizio in un individuo (Phinney et al. 1983). Non era evidente alcuna relazione coerente tra i cambiamenti nell’utilizzo del substrato, come rappresentato dai valori del rapporto di scambio respiratorio (RER) e la resistenza ciclica (Figura 1). Sebbene questo studio abbia fornito aggiornamenti nuovi e illuminanti sui concetti relativi al metabolismo dell’esercizio, la sua traduzione negli sport di resistenza d’élite richiede comunque cautela.
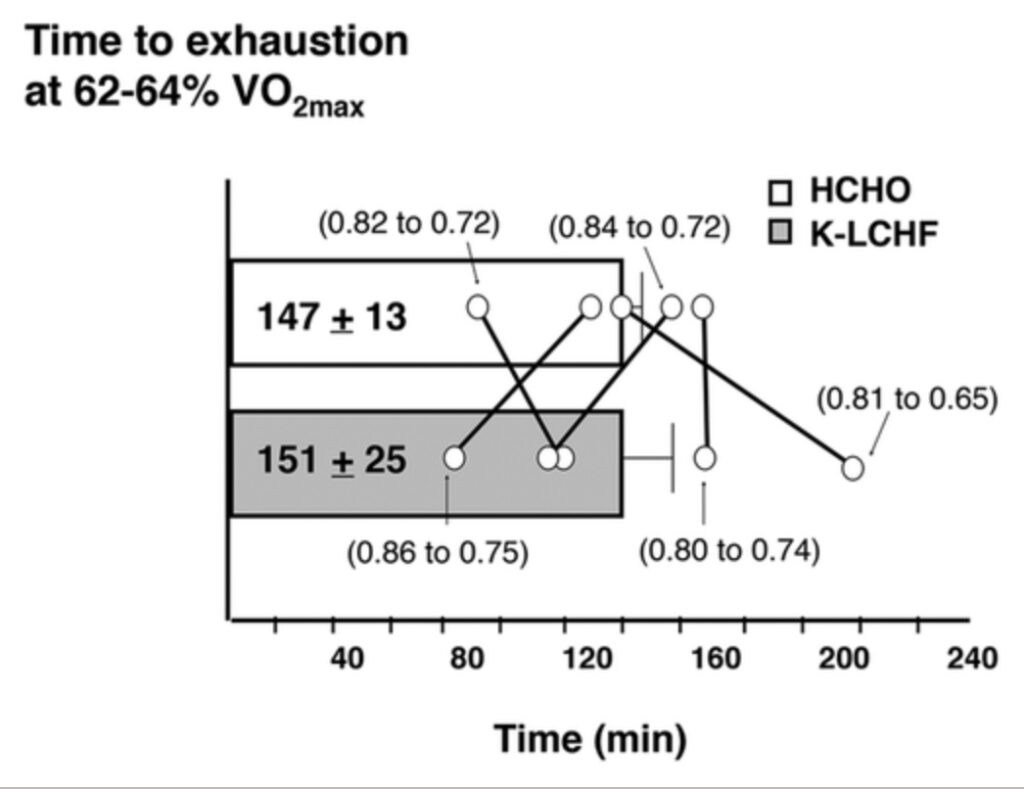
Figura 1: tempo di esaurimento durante il protocollo di ciclismo con 1 settimana di dieta abituale ad alto contenuto di carboidrati (HCHO) seguita da 4 settimane di adattamento alla dieta chetogenica a basso contenuto di carboidrati, ad alto contenuto di grassi (K-LCHF) in 5 ciclisti ben allenati (Phinney et al. 1983 ). I dati sono media ± DS con i singoli risultati identificati (e variazioni medie da HCHO a K-LCHF nel rapporto di scambio respiratorio fornito tra parentesi).
Il RER, si riferisce alla fonte di energia che il tuo corpo utilizza in un dato punto. La maggior parte delle attività che fai durante il giorno utilizzerà un mix di carboidrati e grassi. Tuttavia ci sono eccezioni alla regola. Ad esempio, quando dormi, il substrato utilizzato sarà il grasso. Dopotutto, non stai esattamente rimbalzando sui muri con energia illimitata a quel punto, ma al contrario, fasi di esercizio fisico intenso, come lo sprint, sono quasi esclusivamente alimentati con carboidrati. La RER è in genere misurata su una scala di 0,7 – 1 0.7 indica il solo utilizzo di grassi. E 1 indica il solo utilizzo di carboidrati.
Numerosi fattori influenzano l’equilibrio tra l’utilizzo di carboidrati e grassi, tra cui:
- Durata dell’esercizio;
- Intensità di esercizio;
- Condizioni ambientali (ovvero altitudine e temperatura);
- Il tuo livello di fitness;
- assunzione di cibo pre-esercizio?;
- Dieta abituale;
Il RER (Respiratory Exchange Ratio) determina se il carboidrato e/o il grasso vengono utilizzati durante un’attività specifica.
Molti contributi hanno promosso la probabilità di un risultato benefico a seguito dell’adattamento cheto:
- Un effetto regolativo, con l’integrazione K-LCHF, che beneficia di un ulteriore allenamento di 4 settimane in più per la familiarizzazione del protocollo;
- Un tempo di esaurimento del protocollo a intensità di esercizio modeste che ha rimosso le caratteristiche delle condizioni di gara, come la camminare o intensità di esercizio più elevate;
- Esaurimento delle condizioni ottimali per la sperimentazione HCHO (che ha comportato un digiuno notturno e acqua durante l’esercizio).
Nel 2012 in internet e sui social media è cominciata la promozione entusiastica di K-LCHF per prestazioni di resistenza, nonostante l’assenza di ulteriori indagini e prove scientifiche su affermazioni e ipotesi (Burke, 2015). Per ovviare alla mancanza di prove rigorose e incentrate sullo sport, la ricerca ha reclutato atleti competitivi a livello internazionale, studiati durante la loro vita, per intraprendere 24 giorni di allenamento integrando con K-LCHF (3 settimane di allenamento + 3 giorni di protocollo di prova), usando una serie di test per analizzare il metabolismo e la performance (Burke et al. 2017). È stato mantenuto un rigoroso controllo della dieta e dell’allenamento (Mirtschin et al. 2018), con atleti che hanno seguite diete energetiche, abbinate a proteine che soddisfano gli obiettivi di HCHO, disponibilità periodica di CHO (PCHO) o una versione aggiornata del Dieta Phinney, resa popolare in un libro (Volek & Phinney, 2012).
Ogni gruppo ha ottenuto un miglioramento della capacità aerobica attraverso il campo di addestramento, mentre il gruppo K-LCHF ha riportato aumenti sostanziali dei tassi di ossidazione dei grassi durante un test di gestione graduale (circa 60-90% del VO2 max) e un allenamento prolungato (2 ore) a un ritmo correlato all’evento di marcia di 50 km (circa il 75-80% del VO2max). Ciononostante K-LCHF non è riuscito a raggiungere un tempo più veloce in una gara su pista da 10.00 m (-1,6%, NS), mentre il gruppo HCHO è migliorato significativamente del 6,6% (Burke et al. 2017). Questo protocollo di gara è stato criticato dai social media come non limitato dall’esaurimento del glicogeno come eventi atletici più lunghi (ad es. maratona/50 km di marcia). In confutazione è stato scelto un’attività che ha permesso di ripetere le massime prestazioni entro un periodo di 3 settimane e ha comportato intensità di importanza critica per le strategie di stimolazione degli eventi internazionali di 20 e 50 km (Huebsch, 2019). Inoltre il miglior tempo personale di 10 km è stato segnalato come un buon predittore delle prestazioni della maratona in corridori di distanza specializzati (Noakes et al. 1990).
Dato che la maggiore fatica e la ridotta qualità degli allenamenti associati al K-LCHF si riducono dopo circa 2 settimane (Phinney et al. 1983; Burke et al. 2017, 2020), gli autori non ritenevano che ciò contribuisse ai risultati prestazionali di gara. Al contrario hanno attribuito l’incapacità del gruppo K-LCHF di ottenere i miglioramenti delle prestazioni attese in termini di riduzione dei consumi (cioè in aumento dell’utilizzo dell’ossigeno) della corsa a piedi sull’ossidazione dei grassi. Un aumento del costo dell’ossigeno per la produzione di ATP dall’ossidazione del grasso rispetto alla CHO è conosciuto empiricamente da un secolo (Zuntz & Schumburg, 1901; Krogh & Lindhard, 1920), con i cambiamenti nell’utilizzo del substrato che già erano noti per la loro funzione di cambiare l’economia della corsa (Kirwan et al. 1988) e del ciclismo (Cole et al. 2014). Ciò può essere spiegato dalla stechiometria delle reazioni ossidative. Nonostante una maggiore resa ATP per unità di substrato da grasso, il metabolismo CHO produce un rapporto maggiore tra FADH2 ( con 2 lati di accoppiamento. Il FAD o FADH2, cioè il flavina adenina dinucleotide, è un importante fattore ossidante nella b-ossidazione degli acidi grassi e nel ciclo di Krebs ed interviene nel trasporto degli elettroni nel processo biochimico chiamato catena di trasporto degli elettroni) e NADH (3 siti di accoppiamento nella catena di trasporto degli elettroni) rispetto alla ß-ossidazione, ottenendo così una maggiore resa dell’ATP per unità di consumo di ossigeno tramite fosforilazione ossidativa nella catena di trasporto degli elettroni (Leverve et al. 2007).
Il NADH è stato scoperto nel 1904 da Harden e Young, in una miscela di composti ottenuta da estratti deproteinizzati di lievito, fu successivamente isolato nel 1936 da von Euler, Walburg e Christian. Il NAD ha un ruolo essenziale in moltissime reazioni chimiche, fra le quali vanno ricordate alcune tappe della glicolisi* (la scissione del glucosio) e del ciclo di Krebs (un ciclo metabolico che è di fondamentale importanza in tutte le cellule che utilizzano ossigeno nel processo di respirazione cellulare). Il NAD e il NAD fosfato costituiscono le due forme attive della niacina (nota anche come vitamina B3, vitamina PP o vitamina antipellagra –la sigla PP sta per Pellagra Preventing); sia la vitamina PP che il NAD sono presenti in natura in diversi alimenti (carni rosse, fegato, frutta secca, legumi, pesce, pollame ecc.) e un’alimentazione equilibrata assicura un giusto apporto di questi micronutrienti (la pellagra è una patologia che nei tempi passati colpiva soprattutto coloro che si nutrivano prevalentemente di mais; adesso si verifica soltanto in casi particolari quali denutrizione o alcolismo cronico).
Come detto, il NADH interviene in vari processi metabolici fra cui il ciclo di produzione aerobica dell’energia; è proprio su questo presupposto che si basano le raccomandazioni relative all’integrazione alimentare con NADH (in soldoni: più NADH, maggiore energia!); dal momento che il NADH è anche una sostanza antiossidante, un’integrazione porterebbe a notevoli benefici come, tanto per fare alcuni esempi, rafforzamento del sistema immunitario, protezione dai danni cellulari prodotti da radicali liberi e via discorrendo; dal momento che varie malattie degenerative sono legate ad alterazioni cellulari, si arriva alla frettolosa conclusione che se integriamo con NADH, si riducono i rischi di contrarre pericolose malattie. In realtà le cose non stanno proprio cosi. Il NADH, infatti, è il classico esempio di come una sostanza potenzialmente utile come farmaco (cioè per soggetti malati) venga proposto a tutti come integratore, con l’illogica deduzione “se fa bene a un soggetto malato, figuriamoci a uno sano”.
Il NADH può veramente combattere la fatica e la depressione, debellare la stanchezza di una persona sana, proteggere dal rischio di malattie degenerative o migliorare la prestazione di un atleta? Ma l’integrazione con questo coenzima è veramente interessante? Può veramente combattere la fatica e la depressione, debellare la stanchezza di una persona sana, proteggere dal rischio di malattie degenerative o migliorare la prestazione di un atleta? La risposta è purtroppo no e i motivi sono sostanzialmente due: nella produzione di energia entrano in gioco un centinaio di sostanze principali. Le quantità coinvolte spesso sono decisamente superiori a quelle offerte (per motivi di costo) dall’integrazione.Proponiamo che l’ossigeno, piuttosto che il substrato, la disponibilità possa diventare un fattore limitante per l’esecuzione di eventi di resistenza quando le manipolazioni dietetiche commutano dipendenza da CHO a lipidi. Sebbene ci possa essere una riserva adeguata per un aumento maggiore, e forse impercettibile, della domanda di ossigeno durante l’esercizio fisico di intensità moderata, ciò potrebbe non essere compensabile a intensità più elevate.
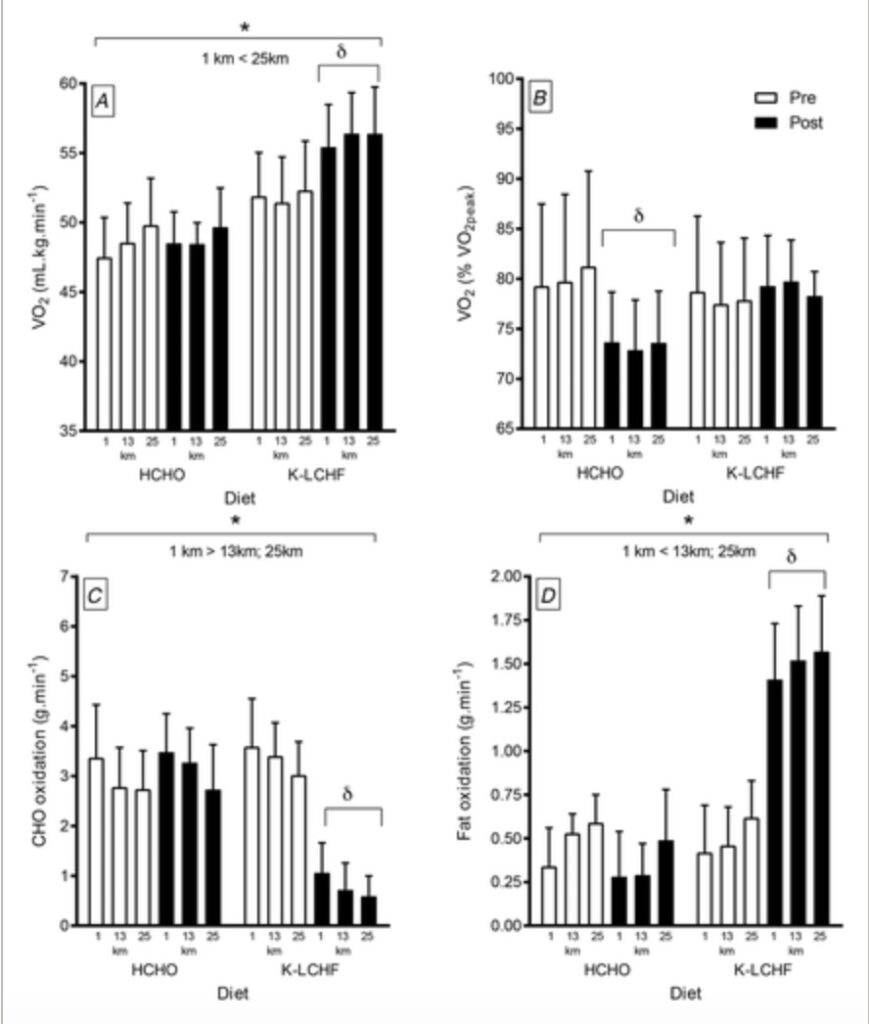
Figura 2: A, in percentuale della capacità aerobica massima (VO2max, B), tassi di ossidazione dei carboidrati (g/min, C) e tassi di ossidazione dei grassi (g/min, D) nei maratoneti maschili d’élite durante una sessione di allenamento di 25 km (circa 2 h) condotta a una velocità correlata a un ritmo di gara di 50 km. I dati sono stati raccolti prima e dopo 3 settimane di adattamento alle diete con elevata disponibilità di carboidrati (HCHO; n= 8) o chetogeniche a basso contenuto di carboidrati e ad alto contenuto di grassi (K-LCHF, n= 10). δ significativamente diverso dal pre-trattamento (P <0,01); * cambiamento significativo durante la sessione di maratona di 25 km. I dati sono raccolti da Burke et al. 2017.
Lo studio di riferimento ha fornito un’illustrazione pratica dell’effetto dello spostamento del substrato; dopo l’allenamento, il gruppo HCHO ha migliorato la propria economia relativa, perché il costo dell’ossigeno del camminare a velocità di gara rappresentava una percentuale inferiore della sua potenziata capacità aerobica. Nel frattempo un aumento del costo assoluto dell’ossigeno dell’esercizio nel gruppo K-LCHF ha impossibilitato l’aumento del VO2 di picco. Burke et al. 2020 hanno scoperto che le donne partecipanti all’interno del gruppo di maratoneti d’élite, hanno ottenuto risultati quasi identici alla precedente indagine in termini di utilizzo del substrato di esercizio e cambiamenti a livello di risparmio energetico. Un margine equivalente tra le gare su pista da 10.000m pre e post studio (con una differenza di circa il 7% tra i gruppi HCHO e K-LCHF, con un miglioramento significativo (4,8%) e una riduzione significativa (2,3%) dei tempi di gara, rispettivamente; Burke e altri (2020) forniscono ulteriore fiducia a riguardo.
I risultati di ulteriori indagini su K-LCHF nei maratoneti sulla durata di 4-6 settimane contraddicono il lavoro precedentemente descritto. In uno studio su maratoneti e triatleti, Shaw e colleghi (2019) hanno confermato tramite dati di assunzione dietetica autoriportati e monitoraggio occasionale di marcatori di chetosi nel sangue e nelle urine, che gli elementi chiave della dieta LCHF possono essere implementati al di fuori di un ambiente controllato. Sebbene il trattamento incrociato della “dieta abituale” fosse inferiore nella CHO rispetto ad altri interventi HCHO, prima e durante il protocollo di prestazione (l’esaurimento sul tapis roulant arrivava al 70% del VO2 max), i soggetti hanno ricevuto un sostegno nutrizionale adeguato all’energia adeguato al loro intervento dietetico. Non sono state riscontrate differenze nel tempo di esecuzione medio (circa 4 ore o circa 50 km), nei 31 giorni di adattamento in entrambi i trattamenti. Tuttavia contrariamente a una riduzione della variabilità dei risultati nella condizione HCHO post-trattamento, vi è stato un raddoppio nel range dell’intervallo di confidenza del 90% con K-LCHF. Inoltre si è verificata una riduzione nell’esercizio d’intensità elevata, basata su una limitazione della RER, sul troncamento dell’ossidazione CHO e su una riduzione di 1 km/h della velocità del tapis roulant al VO2 max (Shaw et al.2019). La dieta K-LCHF ha dimostrato di alterare il microbioma orale, riducendo i batteri anaerobici coinvolti nella conversione del nitrato di origine alimentare in nitrito all’interno del percorso enterosalivario della produzione di ossido nitrico (NO) (Murtaza et al.2019). Poiché altri disturbi al microbioma orale (ad esempio mediante l’uso di collutori antimicrobici) sono associati a una riduzione delle funzioni attribuite alla produzione di NO (Petersson et al. 2009), una perdita di fondo di attività NO potrebbe contribuire a una riduzione di base nell’economia dell’ossigeno. Tali speculazioni giustificano un’indagine mirata.
Un elemento finale dello studio Shaw 2019 prevede un possibile indicatore della reattività individuale a K-LCHF. In effetti oltre ad una maggiore variabilità nei risultati del protocollo di resistenza, K-LCHF includeva due soggetti che non riuscivano a completare il trattamento a causa della non conformità. Gli autori hanno osservato che gli atleti che hanno mantenuto la loro capacità di corsa con la dieta ricca di grassi hanno mostrato un RER> 1,0 rispetto al VO2max segnalando una conservazione della capacità di ossidazione CHO a intensità di esercizio più elevate. Nel frattempo quelli con resistenza compromessa hanno mostrato una RER< 1,0 e un aumento delle concentrazioni di lattato plasmatico, interpretati come una ridotta capacità ossidativa delle riserve muscolari di glicogeno. Sono necessarie ulteriori indagini per confermare questi risultati e per valutare se l’ossidazione “smussata” della CHO segnala adattamento o mal adattamento alla dieta K-LCHF e se rappresenta una differenza persistente tra i soggetti o un diverso corso temporale di adattamento tra gli individui. I risultati di uno studio incrociato di corridori amatoriali (Prins et al.2019), che coinvolgono una serie di prove a cronometro su tapis roulant da 5 km durante 6 settimane di diete o K-LCHF o HCHO forniscono alcuni contrasti con altri studi.
Nello studio amatoriale una dieta K-LCHF ha raggiunto livelli sostenuti di chetosi (digiuno [β-HB]: circa 0,5 mmol/l) e aumenti dei tassi massimi di ossidazione dei grassi (da 0,66 a 1,26 g/min). Sebbene la prima cronometro (adattamento di 4 giorni) sia stato più lento del corrispondente test HCHO, ulteriori prove sono state intraprese dopo 14, 28 e 42 giorni ed il test del VO2max non è riuscito a trovare differenze significative rispetto al trattamento HCHO (Prins et al.2019). Gli autori hanno dichiarato che i loro risultati contraddicono la teoria della capacità ridotta per prestazioni di resistenza di maggiore intensità con K-LCHF, osservando che le cronometro sono state intraprese con un costo dell’ossigeno di circa l’80 del VO2max. Hanno attribuito il continuo contributo dell’ossidazione CHO alle richieste di carburante a una conservazione di glicogeno muscolare. Tuttavia l’assorbimento di ossigeno medio durante le crono è diminuito nel corso del trattamento HCHO, mentre il contrario si verifica durante il trattamento K-LCHF; ciò conferma la differenza nell’economia di esercizio dovuta alla scelta del substrato. Inoltre ciò non preclude la compromissione dell’utilizzo e delle prestazioni del glicogeno a intensità di esercizio ancora più elevate rispetto a quelle raggiunte nei 5 km. In effetti l’adattamento a una dieta LCHF non chetogenica è stato in grado di mantenere intensità cicliche che rappresentano l’80-85% del massimo carico di lavoro, ma ha compromesso i carichi di lavoro oltre il 90% dei W/kg (Havemann et al. 2006). È opportuno considerare anche se alcuni aspetti di questo modello (soggetti amatoriali, cronometro su tapis roulant, la distrazione del metabolimetro) siano sufficientemente validi e sensibili per rilevare alterazioni delle prestazioni negli atleti d’élite.
Lo studio finale ha previsto un adattamento di 12 settimane a K-LCHF in gruppi abbinati di atleti di resistenza (McSwiney et al.2018). Venti atleti hanno completato lo studio, intraprendendo una cronometro ciclistica appositamente progettata per 100 km prima e dopo l’allenamento strutturato che prevedeva delle sedute di resistenza, alta intensità e resistenza. Sia il gruppo K -LCHF sia i gruppi di trattamento CHO abituale “elevato” hanno ottenuto miglioramenti nella forma fisica aerobica, senza un cambiamento significativo nel tempo totale di 100 km. Tuttavia K-LCHF ha aumentato significativamente il picco di potenza, ma non la potenza media (espressa in W/kg rispetto all’Indice di Massa Corporea) in uno sprint di 6s all’inizio della cronometro e in un test di potenza massima di 3 minuti alla fine, studiato per stimolare la fine di una prestazione a seguito della deplezione del glicogeno (McSwiney et al.2018).
Nell’interpretazione di questi risultati si notano diverse avvertenze. In primo luogo, i risultati rappresentano nove atleti che hanno completato la dieta K-LCHF e il protocollo di test e il fatto che altri sette soggetti non abbiano rispettato la dieta o completato i test post-trattamento, rafforzano la variabilità individuale nella risposta. In secondo luogo il gruppo K-LCHF aveva livelli di grasso corporeo significativamente più elevati all’inizio del trattamento e ha registrato una perdita di circa 4 kg di grasso corporeo; un significativo effetto confondente sulle prestazioni, in particolare per la potenza riportata rispetto all’Indice di Massa Corporea). Infine la dieta del gruppo HCHO non è riuscita a soddisfare le linee guida per un’attività di resistenza di 2,5 ore e potrebbe aver portato a prestazioni non ottimali nella cronometro.
Gli studi su K-LCHF e le prestazioni di resistenza sono scarsi ed non omogenei in termini di calibrazione dell’atleta, durata dell’adattamento e tipologia del protocollo d’allenamento e in termini complessivi suggeriscono che le prestazioni di un esercizio di intensità moderata possono essere preservate in seguito all’adattamento cheto, ma i risultati individuali possono essere estremi in entrambe le direzioni (positive e negative) e sopratutto includenti l’incapacità di tollerare o rispettare le restrizioni dietetiche. È importante sottolineare che non ci sono prove di un costante miglioramento delle prestazioni anche a tali intensità. È probabile una riduzione delle prestazioni di alta intensità, potenzialmente attribuibile a un costo dell’ossigeno più elevato, che impedisce all’atleta di sostenere carichi di lavoro ad alte proporzioni rispetto alla propria massima capacità aerobica.
Questi risultati supportano i precedenti suggerimenti secondo cui la dieta K-LCHF potrebbe non essere adatta agli eventi in cui l’esercizio fisico ad alta intensità è fondamentale per il successo, ma potrebbe essere utile in scenari specifici come l’esercizio fisico ad intensità moderata che può essere supportato dall’ossidazione dei grassi, specialmente in presenza di incapacità o riluttanza a utilizzare strategie per mantenere un’elevata disponibilità di CHO (Burke, 2015). I benefici potrebbero anche essere visti quando la dieta K-LCHF supporta la perdita di grasso corporeo negli atleti in sovrappeso.
Nel contemplare il potenziale uso delle diete K-LCHF in termini di risultati delle prestazioni sportive, gli atleti dovrebbero controllare le loro attività allenanti o le esperienze personali per identificare l’importanza relativa della loro capacità per l’esercizio aerobico ad alta intensità contro il rischio di esaurimento delle riserve di CHO (Burke et al. 2020). Altri hanno suggerito un controllo della produzione energetica media o massima/critica richiesta durante l’attività per il singolo atleta e di come l’ossidazione dei grassi possa supportarlo (Maunder et al. 2018). Ad esempio l’analisi di un Ironman ha rilevato che gli atleti d’élite lavorano a tassi assoluti più elevati di dispendio energetico e ad una proporzione più elevata del loro limite di dispendio energetico rispetto ai loro omologhi più lenti. Un modello delle caratteristiche dei migliori atleti (basato su velocità, potenza e economia d’esercizio in corsa, ciclismo e nuoto) suggerisce che una maggiore ossidazione dei grassi, tipica dell’adattamento cheto, non riuscirebbe a supportare i requisiti di 8 ore di attività continua, ma potrebbe essere sufficiente per il fabbisogno energetico dei concorrenti più lenti con tempi >12 h (Maunders et al. 2018).
Si sostiene che l’esposizione cronica a una dieta K-LCHF raggiunga una serie di risultati metabolici e funzionali (Volek et al. 2015). Il primo studio sulla dieta e sugli atleti di resistenza K-LCHF (Phinney et al. 1983) ha concluso che l’esposizione a 4 settimane ha ottenuto un ritorno al benessere e notevoli cambiamenti nell’utilizzo del carburante durante l’esercizio. Il successivo studio (Burke et al. 2017) basato anche su questo lavoro, così come dalle dichiarazioni all’interno di altri (Volek & Phinney, 2012), ha pubblicato riviste scientifiche (Volek et al. 2015) responsabili della rinascita dell’interesse per il K-LCHF che l’adattamento cheto si è verificato rispettivamente entro “due o più settimane” e “3-4 settimane”. Ciononostante lo studio è stato fermamente criticato in quanto troppo breve per consentire che si verifichino importanti adattamenti metabolici, suggerendo che sono necessari “diversi mesi” per ottenere il massimo beneficio (Burke et al. 2020). Un’indagine sistematica e ben controllata è chiaramente giustificata dall’andamento temporale dei cambiamenti nella percezione dello sforzo e dello stato di benessere, dell’utilizzo del carburante e delle prestazioni a seguito dell’integrazione di K-LCHF.
Riduzioni del benessere (ad es. affaticamento, irritabilità, perdita di concentrazione) e aumento della percezione dello sforzo durante l’esercizio fisico sono chiaramente evidenti nei primi giorni di esposizione a una dieta K-LCHF. Questi sintomi presumibilmente riflettono la mancanza di substrato CHO nel muscolo e nel cervello prima del potenziamento dell’utilizzo del grasso muscolare e dell’istituzione di un supporto chetonico prolungato per il sistema nervoso centrale (SNC). La letteratura nota anche che i sintomi dell’”influenza cheto” possono riflettere ampi cambiamenti di elettroliti e fluidi derivanti dalla risposta renale iniziale alla dieta chetogenica (Volek & Phinney, 2011). McSwiney & colleghi (2018) hanno riferito che i soggetti hanno sofferto di affaticamento e compromissione delle prestazioni per i primi 7-10 giorni di adattamento alla dieta K-LCHF, con una difficoltà di crescita nelle prestazioni che persiste per 4-6 settimane. Tuttavia nel caso di atleti ben allenati, la capacità di allenamento viene in genere ripristinata entro 2-3 settimane (Phinney et al. 1983; Burke et al. 2017, 2020), sebbene i risultati coerenti della reattività e difficoltà individuale suggeriscono che per alcuni atleti potrebbero persistere problemi. L’esercizio fisico ad alta intensità (>70% del VO2max) è associato a frequenze cardiache più elevate e a percezione dello sforzo negli atleti dopo circa 4 settimane di adattamento cheto, fino a quando durante l’allenamento la capacità è stata ripristinata (Burke et al.2017; Shaw et al.2019).
I corpi chetonici forniscono un substrato per i tessuti periferici, inclusi cuore, sistema nervoso centrale e muscolo scheletrico, ma il loro contributo come substrato di esercizio è modificato da fattori tra cui il protocollo utilizzato per raggiungere la chetonaemia (dieta chetogenica, digiuno prolungato/digiuno, assunzione esogena), stato di allenamento, stato nutrizionale in fase acuta e caratteristiche dell’esercizio (Evans et al. 2017; Pinckaers et al. 2017). Gli studi disponibili sulle diete K-LCHF in atleti ben allenati/d’élite non hanno studiato in modo specifico l’entità o l’importanza dell’utilizzo di chetoni durante l’esercizio sul metabolismo o sulle prestazioni e per questo non è possibile fare ulteriori commenti.
Cambiamento nell’ossidazione dei grassi nel corso del tempo
L’adattamento alla dieta K-LCHF è accompagnato da un sostanziale aumento della capacità di ossidazione dei grassi muscolari durante l’esercizio fisico, nonostante l’aumento della capacità ossidativa muscolare e dell’utilizzo dei grassi raggiunti con l’allenamento (Spriet, 2014). Fino ad oggi nessuno studio di K-LCHF e sport di resistenza ha studiato direttamente i meccanismi alla base del miglioramento dell’utilizzo dei grassi. Tuttavia studi precedenti riguardanti le diete NK-LCHF hanno riportato aumenti del trigliceride intramuscolare (Yeo et al. 2008b), lipasi sensibile agli ormoni (Stellingwerff et al. 2006) e l’espressione dell’acido grasso translocasi FAT/CD36 (Cameron ‐ Smith et 2003) e della carnitina palmitoil transferasi (Goedecke et al. 1999). Collettivamente questi cambiamenti suggeriscono un aumento della disponibilità di grasso, mobilizzazione e attività di trasporto nell’ambito della complessa regolazione dell’utilizzo del grasso da parte del muscolo.
Diversi metodi sono stati usati per misurare e rappresentare l’ossidazione dei grassi nell’esercizio nella letteratura attuale su K-LCHF negli atleti allenati per la resistenza. Alcuni ricercatori (Volek et al. 2016) hanno intrapreso protocolli standardizzati per misurare i tassi massimi di ossidazione dei grassi (Fatmax) in cui l’utilizzo del substrato viene valutato dai dati dei gas respiratori durante un test in condizioni di digiuno e modesti incrementi dell’intensità dell’esercizio consentono previsione del tasso massimo di ossidazione dei grassi e della percentuale di VO2max al quale si verifica (Achten et al. 2002).
In alternativa i tassi di ossidazione dei grassi vengono semplicemente misurati durante l’esercizio prolungato e possono riflettere i cambiamenti del substrato durante un periodo di esercizio più lungo, nonché l’assunzione di cibi ricchi di grassi prima e durante il protocollo (Burke et al. 2017, 2020). Sebbene l’ossidazione del grasso sia tipicamente riportata in grammi al minuto, queste percentuali variano in base alla potenza assoluta erogata (ovvero la dimensione corporea dell’atleta e la capacità aerobica assoluta), la modalità di esercizio e le caratteristiche nutrizionali. Nonostante queste differenze nelle metodologie, studi della durata di 3-4 settimane che coinvolgono un controllo rigoroso dell’intervento K-LCHF hanno riportato valori medi per l’ossidazione massima dei grassi di circa 1,5 g/min che rappresentano il 200–250% dei valori associati a una dieta HCHO (Phinney et al. 1983; Burke et al.2017, 2020). Considerando che si possono osservare tassi fino a 2 g/min in individui altamente allenati (Burke et al. 2017; Webster et al.2018), i tassi riportati in altri studi sono stati leggermente inferiori (1,2-1,3 g/min), forse riflettendo un livello di allenamento/calibro inferiore o un controllo dietetico meno rigoroso (Prins et al.2019; Shaw et al.2019). I protocolli Fatmax riportano uno spostamento nell’intensità con cui si verificano tassi massimi di ossidazione dei grassi da circa il 45% a circa il 70% del VO2max (Shaw et al.2019). Periodi più lunghi (6-12 settimane) di esposizione alla dieta K-LCHF non cambiano queste osservazioni (McSwiney et al.2018; Prins et al.2019), suggerendo che il massimo potenziamento dell’ossidazione del grasso muscolare si verifica entro 3-4 settimane dal cheto adattamento. Pertanto a meno che non siano disponibili informazioni diverse sui processi e sull’andamento temporale degli spostamenti del substrato durante l’adattamento cheto, le 3-6 settimane dovrebbero essere considerate un periodo di adattamento a medio termine, con un’esposizione a lungo termine >3-4 mesi.
In assenza di studi di intervento controllato di durata superiore a 12 settimane, le informazioni sull’ossidazione dei grassi a seguito di un adattamento a lungo termine a K-LCHF sono meglio fornite da studi trasversali di atleti di resistenza ben allenati che hanno selezionato da sé tali diete per periodi prolungati. Sono stati pubblicati due di questi studi, che coinvolgono ciclisti (Webster et al. 2016) con 13 mesi di adesione a una dieta K-LCHF (intervallo: 8-22 mesi) o triatleti e corridori di successo ultra-endurance (Volek et al. 2016) con 20 mesi di esposizione (9-26 mesi). Questi atleti sono stati quindi confrontati con i controlli fisici e sportivi a seguito di diete abituali che forniscono >50% E da CHO. Sebbene l’autoselezione possa aver convogliato gli atleti a diete adatte a loro, il confronto delle caratteristiche metaboliche tra i gruppi potrebbe fornire informazioni sullo stato adattivo ottimale per ciascun approccio. I ciclisti si sono abituati a una dieta K-LCHF (circa 50 g/giorno o 7% di energia CHO; circa il 72% di grassi) hanno sostenuto un’ossidazione media dei grassi di 1,2 g/min durante 2 ore in bicicletta a circa il 70% del VO2max, mentre il gruppo di confronto che segue diete CHO più elevate ha raggiunto una deriva graduale a 0,5 g/min (Webster et al. 2016), nel frattempo un protocollo classificato che prevede fasi di esercizio brevi (2 min) in atleti d’elite ultra-distanza, hanno mostrato una Fatmax di 1,54 ± 0,18 g/min a circa il 70% del VO2max nel gruppo K-LCHF (circa 82 g/giorno o 10% CHO, circa il 70% di grasso), rispetto a 0,67 ± 0,14 g/min a circa il 55% del VO2max nel gruppo di controllo (Volek et al. 2016). Questi stessi atleti avevano tassi di ossidazione del grasso di 1,21 vs. 0,76 g/min su 3 ore di tapis roulant sottomassimale al 64% del VO2max, a seguito di un pasto pre-esercizio con dieteta abituale (Volek et al. 2016). Questi risultati suggeriscono l’assenza di ulteriori cambiamenti nella capacità di ossidazione dei grassi oltre 3-4 settimane di esposizione a K-LCHF.
Una domanda più interessante è se l’adattamento cheto effettivamente richiede 3-4 settimane per raggiungere i tassi massimi di ossidazione dei grassi. I primi studi di 3-4 giorni di restrizione CHO (Ahlborg et al. 1967; Bergstrom et al. 1967) hanno riportato una deplezione di glicogeno e una mancanza di adattamento metabolico e in accordo con Prins e altri (2019), una riduzione della capacità/prestazione di resistenza. Tuttavia gli studi di una dieta LCHF non chetogenica (Burke et al. 2000, 2002; Carey et al. 2001) e dell’Università di Cape Town (Goedecke et al. 1999; Havemann et al. 2006) hanno riportato solide modifiche alla mobilizzazione, al trasporto, all’assorbimento e all’ossidazione dei grassi dopo un’esposizione di 5-6 giorni. In effetti Goedecke e colleghi (1999) hanno riportato la comparsa di alterazioni delle caratteristiche muscolari e dell’utilizzo del substrato in ciclisti ben allenati di 5 giorni di NK-LCHF che non sono stati ulteriormente migliorati dopo un’esposizione di 10 giorni. Sono stati riportati tassi di ossidazione del grasso corporeo di circa il 60 e 70 µmol kg/min in ciclisti ben allenati durante le sessioni di allenamento all’85% e al 65% del VO2max, rispettivamente con un periodo di adattamento di 4-5 giorni (Stepto et al. 2002). Ciò si avvicina a tassi assoluti di ossidazione dei grassi di circa 1,3-1,5 g/min, che rappresentano un raddoppio di questo uso di substrato nelle stesse condizioni in un trattamento HCHO incrociato. Su queste basi, viene proposta una definizione del periodo di adattamento a breve termine compreso tra 5 e 10 giorni.
Cambiamenti nel metabolismo dei CHO nel corso del tempo
È importante sottolineare che gli studi di 3-4 settimane K-LCHF mostrano la presenza di depositi endogeni di CHO nonostante l’assunzione minima di CHO. Ad esempio le concentrazioni di glucosio nel sangue vengono mantenute a riposo e durante l’esercizio, sebbene a livelli ridotti, mentre sono evidenti aumenti delle concentrazioni di lattato nel sangue durante i test per la capacità aerobica (Phinney et al. 1983; Burke et al.2017; Shaw et al.2019). Anche con la più grande restrizione CHO nella dieta (<20 g/giorno per 4 settimane), Phinney e colleghi (1983) hanno notato una riduzione del 47%, piuttosto che un’assenza di depositi di glicogeno muscolare. Per l’importanza del glucosio come substrato per molti tessuti e fonte di carbonio per la biosintesi e l’anaplerosi (le reazioni anaplerotiche sono quell’insieme di reazioni che servono per rifornire il ciclo di Krebs degli intermedi sottratti per la sintesi di vari composti, come il glucosio da Acido Ossalacetico, gli acidi grassi e gli steroli dall’Acido Citrico, senza passare attraverso la formazione di Acetil-CoA), ciò conferma che gli esseri umani possono adattarsi alla privazione di CHO sintetizzando il glucosio da una varietà di substrati (Soeters et al. 2012).
Nel confrontare i risultati di studi a breve termine e studi trasversali prolungati per l’adattamento cheto, rispettivamente, Phinney et al. (1983) e Webster et al. (2016) hanno utilizzato la tecnologia di tracciamento e la biopsia muscolare per triangolare i cambiamenti nel metabolismo CHO a riposo e in correlazione all’esercizio. Phinney e collaboratori (1983) hanno stimato che l’utilizzo di glicogeno si era ridotto di 4 volte e l’utilizzo di glucosio nel sangue di 3 volte, durante un’intensità moderata (62-64% del VO2max) durante l’attività ciclistica dopo una dieta K-CHF di 4 settimane, ipotizzando che la gluconeogenesi (da glicerolo, lattato, piruvato e aminoacidi gluconeogenici) fosse in grado di mantenere le concentrazioni di glucosio nel sangue e consentire il ripristino del glicogeno durante il recupero dall’esercizio. Webster e altri (2016) hanno misurato la cinetica del glucosio a riposo e durante 2 ore di ciclismo con un’intensità leggermente più elevata (circa il 70% del VO2max), riportando una produzione endogena di glucosio (EGP) inferiore a riposo e durante l’esercizio in atleti ultra-endurance adattati al cheto rispetto agli atleti che consumano diete CHO più elevate. Ipotizzarono che la riduzione dell’EGP rappresentasse una riduzione della disgregazione del glicogeno epatico senza compensazione di un aumento assoluto della gluconeogenesi. Sebbene i tassi assoluti di gluconeogenesi fossero simili tra i gruppi, hanno contribuito a una proporzione maggiore di depositi CHO corporei nel gruppo K-LCHF e provenivano da substrati diversi; glicerolo, nel caso del gruppo K-LCHF, e lattato nel caso del gruppo HCHO (Webster et al. 2016). Questi due studi danno una comprensione migliore dell’adattamento a medio e lungo termine del metabolismo CHO verso diete K-LCHF, sia nei cambiamenti nel tempo, che nelle varie metodologie dirette (tracciamento e biopsia) e indirette (stime dai dati sui gas respiratori) per valutare l’uso del substrato. Tuttavia le osservazioni sull’adattamento a lungo termine di Volek e colleghi (2016) forniscono una sorprendente contraddizione con il resto della letteratura, poiché questi dati sono stati scelti per rispondere e giustificare le critiche a tutti gli studi sul K-LCHF a medio termine e per promuovere una teoria unica dei benefici dell’adattamento chetonico a lungo termine, per questo un esame più attento è obbligatorio.
Dieci ultra-corridori/triatleti ad alte prestazioni cronicamente adattati per cheto hanno intrapreso una corsa di 3 ore al 65% del VO2max dopo aver consumato uno spuntino ricco di grassi (31g di grasso), quindi hanno recuperato per 2 ore successivamente ad un’altra assunzione di questo spuntino (Volek et al. 2016). Il gruppo HCHO ha completato la corsa con spuntini energetici pre e post esercizio fornendo 43g di CHO. Alti tassi di ossidazione dei grassi (circa 1,2 g/min) e bassi tassi di ossidazione CHO (<0,5 g/min) sono stati osservati nel gruppo K-LCHF, mentre l’ossidazione CHO nel gruppo HCHO è diminuita da circa 1,7 a circa 1,2 g/min nel corso della sessione in cui è stata assunta acqua (Fig. 3A). Tuttavia i dati derivati dalla biopsia hanno mostrato una serie di incoerenze (Fig. 3B):
- Uguale conservazione del glicogeno pre e post esercizio nonostante le grandi differenze nell’assunzione di CHO;
- Uguale degradazione del glicogeno durante l’esercizio con un destino non ossidativo per il gruppo K-LCHF.
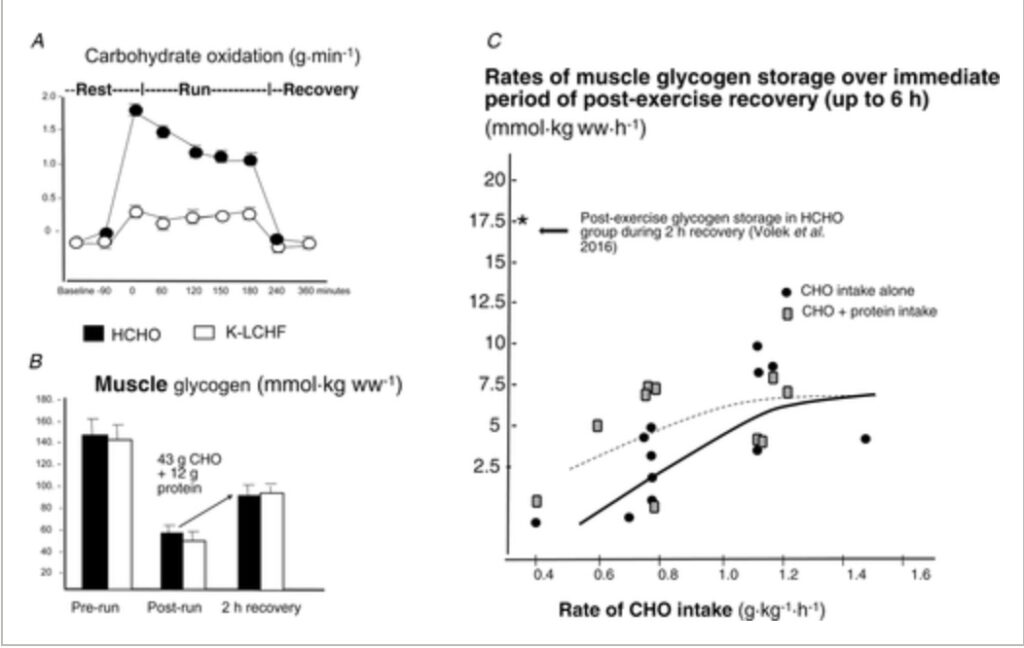
Figura 3: A, tassi di ossidazione della CHO (g/min) prima, durante e dopo 3 ore di tapis roulant di corsa al 65% del VO2max negli atleti ultra-endurance adattati alla dieta K-LCHF da un periodo superiore a 9 mesi. B, contenuto di glicogeno muscolare (mmol/kg) nei corridori ultra-endurance che consumano abitualmente una dieta K-LCHF o una dieta ricca di carboidrati (HCHO) prima e dopo una corsa su tapis roulant di 3 ore e dopo 2 ore di recupero. I tassi di conservazione del glicogeno muscolare in 2 ore di recupero nei corridori ultra-endurance adattati a HCHO (Volek et al. 2016) sono giustapposti al riepilogo della letteratura sui tassi medi di conservazione del glicogeno in individui allenati per 2-6 ore di recupero post-esercizio ( ridisegnato da Betts & Williams, 2010).
È stato proposto che un prolungato adattamento cheto ripristina la capacità del muscolo di sintetizzare il glicogeno, che ha quindi un destino non ossidativo durante l’esercizio come fonte intermediaria per il ciclo dell’acido citrico e la gluconeogenesi nel fegato (Volek et al. 2016). Gli autori hanno osservato che cani da slitta (McKenzie et al. 2005) e cavalli (Hyyppa et al. 1999) sono noti per adattarsi alle diete LCHF in modo tale che le riserve di glicogeno si normalizzino ai livelli associati alle diete ricche di CHO. Mentre il concetto proposto da Volek & colleghi (2016) è intrigante e merita un’ulteriore valutazione sistematica, per il momento, ci sono forti ragioni per rifiutare i dati atipici su cui si basa, piuttosto che una base per nuove strade operative a lungo termine per l’adattamento alle diete K-LCHF. In primo luogo questi risultati sono in contrasto con le osservazioni di studi simili condotti su atleti adattati a lungo termine e le indagini sull’adattamento a medio termine. Il secondo è il presunto valore del destino non ossidativo di grandi quantità di glicogeno muscolare, specialmente se la circostanza dell’autoselezione dello studio indica che questi atleti si sono adattati in modo ottimale alla dieta K-LCHF. In effetti Prins e altri (2019) e Shaw e altri (2019) hanno osservato che la conservazione di alti tassi di ossidazione CHO a fronte dell’adattamento cheto a medio termine caratterizza i singoli atleti che sono in grado di preservare la loro capacità/prestazione di resistenza. Infine i dati possono essere valutati confrontando i risultati del gruppo HCHO all’interno dello studio con una letteratura abbondante e non controversa, raccolta in quasi 6 decenni, di conservazione del glicogeno muscolare in atleti allenati in endurance. La Figura 3C, presa da Betts & Williams (2010) riassume nove studi basati sulla biopsia della conservazione del glicogeno durante il recupero post-esercizio in relazione all’assunzione di CHO in questo periodo. Quando i risultati del gruppo HCHO di Volek e altri (2016) sono confrontati a questo sommario, suggeriscono il verificarsi di un evento insolito o problemi con la misurazione del glicogeno, che probabilmente si estende ai risultati della conservazione del glicogeno nel gruppo K-LCHF. Nel complesso è evidente la necessità di riesaminare la proposta secondo cui il ripristino completo della conservazione del glicogeno avviene in condizioni di dieta costante di K-LCHF nell’ambito di un’indagine dedicata sugli effetti a lungo termine di questa dieta. Sebbene questa teoria possa essere validata in futuro è difficile giustificare i dati attualmente disponibili.
Periodizzazione K-LCHF e HCHO per ottimizzare le prestazioni
Un approccio ibrido o periodico a strategie che ottimizzano separatamente l’ossidazione di grassi e CHO potrebbe raggiungere il “meglio da entrambi i mondi” per la flessibilità metabolica per gli atleti di resistenza. È possibile avere una serie di opportunità per includere la chetosi nelle “strategie di alimentazione periodica”, sebbene l’adattamento a fonti di chetoni endogeni richieda più di 5 giorni, anziché alcune ore degli integratori di chetoni esogeni (Evans et al. 2017). Sfortunatamente sono disponibili pochi studi su tale periodizzazione. Il moderno fenomeno dei social media consente ai partecipanti allo studio di descrivere le loro esperienze a un vasto pubblico, generando interesse per le loro prestazioni in eventi sportivi omologati. Pertanto un record nazionale infranto con ampio margine da un partecipante allo studio, 3 settimane dopo aver completato 24 giorni di adattamento cheto nel progetto di ricerca, ha creato ipotesi e speculazioni sui social media circa le somiglianze tra la dieta K-LCHF e l’allenamento in altitudine, nel creare un retaggio di cambiamenti fisiologici che potrebbero ben integrarsi verso il momento di gara per poi tornare a HCHO per migliorare le prestazioni (Burke et al. 2020). Per differenziare “gli effetti provocati dall’allenamento” dagli eventuali vantaggi speciali di questo modello di periodizzazione, gli autori hanno intrapreso una nuova indagine sull’implementazione delle diete supportate da K-LCHF o CHO per 25 giorni, seguita da un fase di supporto da HCHO prima dei 20 km di Maratona ai Campionati Australiani. Diverse analisi di gara non sono riuscite a rilevare un miglioramento maggiore con il pre-trattamento K-LCHF rispetto a quello con HCHO durante l’intera preparazione (Burke et al. 2020). Pertanto gli autori hanno respinto la proposta secondo cui l’adattamento periodico a una dieta K-LCHF crea una qualsiasi eredità importante per le prestazioni della corsa, oltre le normali risposte di allenamento. Uno studio più recente ha studiato i potenziali benefici del ripristino acuto del glicogeno muscolare ed epatico dopo adattamento cheto (Burke et al.). Dei maratoneti d’élite hanno intrapreso due gare da 10.000m separate da circa 2 settimane, ognuna preparata con la stessa assunzione di CHO (in 24h 8,5 g/kg più un pasto pre-gara di 2g/kg) e un allenamento leggero per comparare le riserve pre-gara di glicogeno. Tra le gare gli atleti hanno seguito una dieta HCHO per 7–8 giorni prima di essere divisi in gruppi diversi, uno per la dieta sostante di HCHO, l’altro per la dieta K-LCHF per 5-6 giorni. Dei test di valutazione sul risparmio energetico pre e post intervento hanno confermato tassi simili di utilizzo di grassi e CHO nel gruppo HCHO. Tuttavia anche con un breve periodo di adattamento, il gruppo K-LCHF ha mostrato un sostanziale aumento dell’ossidazione massima dei grassi (da circa 0,4 a circa 1,4 g/min). Ulteriori test durante il riscaldamento di gara hanno mostrato che K-LCHF era associato a tassi più elevati di ossidazione dei grassi e solo a un parziale ripristino dell’ossidazione della CHO in Gara 2, nonostante un’identica preparazione dietetica pre-gara. Ancora più importante però sono i dati delle prestazioni in gara che hanno suggerito un continuo deterioramento dell’utilizzo del carburante con K-LCHF. Considerando che tutti i partecipanti nel gruppo HCHO hanno registrato tempi più rapidi in Gara 2 con un miglioramento medio del 5,7%, solo un partecipante alla K-LCHF è migliorato nella seconda gara (media= riduzione del 2,1%); ciò ha replicato la ricerca degli autori di circa l’8% di differenza nelle prestazioni tra i gruppi K-LCHF e HCHO (Burke et al. 2017, 2020).
Havemann e colleghi (2006) hanno dimostrato che i ciclisti adattati a diete non chetogeniche, ma LCHF, seguite da un ripristino delle disponibilità di CHO, hanno mostrato una piccola e non significativa compromissione in prove a cronometro di 100 km, rispetto a una studio controllato con costante HCHO. Tuttavi quando è stato richiesto di effettuare sprint di 1 km a più del 90% del picco di potenza (circa 95% del VO2max) all’interno della prova, si è verificata una riduzione significativa della potenza erogata, nonostante il mantenimento a livello di percezione sia dello sforzo, che della frequenza cardiaca ed un maggiore tentativo di reclutare fibre muscolari (Havemann et al. 2006). Pertanto vi sono prove di una ridotta flessibilità metabolica (cioè alterazione dell’ossidazione del glicogeno disponibile) a seguito dell’adattamento alle versioni chetogeniche e non chetogeniche delle diete LCHF.
La considerazione finale è un caso clinico di un triatleta competitivo ultra-endurance che ha indagato se l’adattamento cheto a lungo termine (circa 2 anni) stava limitando le sue prestazioni nell’ambito di esercizi ad alta intensità (Webster et al.2018). Tre settimane di allenamento con dieta abituale sono state confrontate con lo stesso programma durante il quale ha consumato 60g di CHO in 8 allenamenti di 1 ora ad alta intensità, per annullare potenzialmente una sotto regolazione dell’assorbimento (Costa et al. 2017) e l’utilizzo di CHO durante l’esercizio (Tabella 2). Sebbene lo studio non sia stato in grado di indagare direttamente gli aspetti meccanicistici della sua ipotesi di lavoro, ha fornito un certo controllo e una raccolta di dati sulle strategie discusse come “testimonianza diretta” in altri situazioni, utilizzate da scienziati sportivi, allenatori e atleti. Una serie di test alla fine di ogni periodo, alimentati dalla strategia dietetica prevalente, hanno mostrato un evidente vantaggio dell’esercizio fisico basato sull’ossidazione della CHO (lavoro ad alta intensità della durata di 30s per 20 min.), ma nessun effetto sulla bassa intensità (<60–65% del VO2max) ed esercizio sovramassimale (superiore alla massima capacità aerobica) quando il CHO è stato consumato dopo ogni test. Questi benefici si sono verificati senza sacrificare gli alti tassi di ossidazione dei grassi. Gli autori ammettono che il loro progetto non può isolare i benefici muscolari (Burke & Maughan, 2020) dell’assunzione di CHO durante l’esercizio. Né è possibile separare l’allenamento di qualità superiore nelle sessioni mirate dagli adattamenti, per migliorare l’assorbimento e l’utilizzo delle CHO. Sebbene questo caso di studio incoraggi ulteriori ricerche di questo e di altri modelli di periodizzazione K-LCHF/HCHO (ad es. ripristino in acuto del glicogeno), non include confronti con una disponibilità cronica elevata di CHO. In sintesi sono possibili vari modelli che integrano gli approcci K-LCHF e HCHO all’allenamento e al supporto delle prestazioni e sono praticati nella vita reale degli atleti secondo le testimonianze di atleti di successo e amatoriali, ma pochi sono stati studiati sistematicamente. La letteratura disponibile suggerisce che l’adattamento del cheto può compromettere l’utilizzo del glicogeno muscolare, ostacolando la maggiore disponibilità e capacità di utilizzo sia per il grasso, che per il CHO. Tuttavia potrebbero esserci opportunità per un uso strategico dell’assunzione di CHO esogeno durante sessioni di allenamento ed eventi in cui è richiesto un esercizio di maggiore intensità.
Conclusione
La disponibilità e la capacità di utilizzare tutti i combustibili muscolari per supportare le esigenze specifiche dell’esercizio (“flessibilità metabolica”) è il Santo Graal per gli atleti di resistenza ad alte prestazioni, che spiega il fascino costante delle strategie per utilizzare al meglio le riserve di grasso relativamente illimitate del corpo. Vi sono prove concrete che l’adattamento a una dieta chetogenica LCHF crea sostanziali cambiamenti cellulari per aumentare la motilità, il trasporto, l’assorbimento e l’ossidazione dei grassi durante l’esercizio, anche negli atleti d’élite che si allenano specificamente per ottimizzare i percorsi ossidativi dei grassi. Inoltre sebbene il decorso temporale di tutti i cambiamenti nella funzione corporea con K-LCHF richieda un’indagine sistematica, i cambiamenti massimi al metabolismo dei grassi muscolari si verificano dai 5-10 giorni, fino alle 3-4 settimane di adattamento. I cambiamenti e il significato vero circa l’uso dei chetoni muscolari sono ancora sconosciuti. Sebbene vi siano prove evidenti che l’adattamento del cheto riduce l’ossidazione dei CHO muscolari, i problemi irrisolti sono molti, come la capacità del cheto adattamento a lungo termine di ripristinare il contenuto di glicogeno muscolare a livelli normalmente associati a una dieta ricca di CHO e la compromissione della capacità del muscolo di usare il glicogeno per l’ossidazione. Ciò è importante poiché l’ossidazione dei CHO fornisce una fonte di energia più efficace ed efficiente quando l’apporto di ossigeno diventa limitante. L’incapacità di utilizzare il glicogeno disponibile, sebbene in quantità ridotta con l’adattamento a medio termine a K-LCHF o a livelli normalizzati con strategie per ripristinare/periodizzare l’assunzione di CHO, limita le prestazioni di esercizi di resistenza ad alta intensità. Inoltre è ben nota un’ampia variabilità nella reattività alla dieta K-LCHF, con possibili problematiche ad entrambe le estremità dello spettro delle prestazioni. Gli atleti che stanno valutando l’uso di diete chetogeniche a basso contenuto di carboidrati e ad alto contenuto di grassi dovrebbero controllare la propria attività e le proprie esperienze personali per bilanciare il rischio di prestazioni compromesse nella fase d’esercizio ad alta intensità, con i potenziali benefici della sostituzione di un inevitabile esaurimento dei depositi di carboidrati con maggiore dipendenza dall’uso di grasso muscolare.
Tratto da: Burke L.M., Ketogenic low‐CHO, high‐fat diet: the future of elite endurance sport? The Journal of Physiology – Symposium Review 02 May 2020 – https://doi.org/10.1113/JP278928
