Introduzione
Successivamente ad un episodio d’ictus si assiste ad una funzionale compromissione dell’attività del sistema nervoso che provoca un reclutamento inadeguato dell’unità motoria con compromissione della coordinazione e indebolimento delle contrazioni muscolari. In particolare il danno neuronale porta alla perdita degli input sopraspinali ai motoneuroni spinali. Gli adattamenti corticospinali, propriospinali e spinali neuroplastici indotti dall’allenamento svolgono un ruolo importante nella regolazione dell’aumento della forza e quando si traducono le indicazioni dell’allenamento di forza dalla popolazione generale a quelle con che hanno subito un danno neuro-traumatico, può esserci un’efficacia ridotta a causa delle alterazioni dell’integrità neurologica dei percorsi che sottostanno agli adattamenti stessi. L’allenamento di forza e l’allenamento funzionale focalizzato sul lato più colpito può essere difficile da avviare a causa della debolezza muscolare e della spasticità e ciò ha contribuito all’idea che il sistema nervoso dopo l’ictus possa rappresentare un “terreno incolto” con risposte adattive temporalmente limitate e smussate.
Cenni di Neuroanatomia
Le vie sensitive spinali afferenti alla corteccia cerebrale sono la via spino-bulbo-talamo-corticale e la via spino-talamo–corticale.
. Via spino-bulbo-talamo-corticale= Lemnisco mediale= via delle colonne dorsali
La via spino-bulbo-talamo-corticale trasmette la sensibilità tattile epicritica e la sensibilità propriocettiva cosciente del tronco e degli arti alla corteccia cerebrale a livello dell’area sensitiva primaria localizzata nel lobo parietale dell’emisfero cerebrale:
- Ha origine nei gangli spinali, i quali sono costituiti dai neuroni a T (o protoneuroni sensitivi) che possiedono neuriti che si dividono ciascuno in una fibra periferica che va in periferia terminando in un corpuscolo sensitivo, e in una fibra centrale che entra nel midollo spinale.
- Le fibre centrali dei neuroni a T entrano nel midollo spinale a livello del solco laterale posteriore come fibre radicolari posteriori. Dopo di che si portano nella zona radicolare del midollo spinale dove ciascuna di esse si divide in un ramo ascendente e in un ramo discendente:
I rami discendenti formano il fascio ovale del Flechsig e il fascio a virgola dello Schulze destinati al corno posteriore del midollo spinale.
I rami ascendenti formano il fascicolo gracile del Goll (fibre nate dai gangli spinali compresi tra 1° coccigeo e 5° toracico) e il fascicolo cuneato del Burdach (fibre nate dai gangli spinali compresi tra 4° toracico e 1° cervicale). I fascicoli gracile e cuneato salgono verso l’alto percorrendo il cordone posteriore del midollo spinale e arrivano nella parte inferiore del midollo allungato terminando rispettivamente nel nucleo del fascicolo gracile e nel nucleo del fascicolo cuneato. - Dai nuclei dei fascicoli gracile e cuneato la via prosegue con un unico fascio: il lemnisco mediale o fascio bulbo-talamico. Il lemnisco mediale subito dopo la sua origine si incrocia con quello eterolaterale al davanti del canale centrale, poi piega verso l’alto e si fa ascendente fino a raggiungere e terminare nel nucleo ventrale posteriore del talamo.
- Il nucleo ventrale posteriore del talamo dà origine alle fibre talamo-corticali che entrano nella costituzione della radiazione sensitiva che fa capo alla corteccia cerebrale dei due terzi superiori della circonvoluzione parietale ascendente dell’emisfero cerebrale, sede dell’area sensitiva primaria (aree 3, 1 , 2) (area dove c’è la rappresentazione sensitiva somatotopica di tronco e arti).
. Via spino-talamo-corticale = via lemnisco spinale
La via spino-talamo-corticale trasmette gli impulsi della sensibilità tattile protopatica e delle sensibilità termica e dolorifica del tronco e degli arti alla corteccia cerebrale dell’area sensitiva primaria del lobo parietale dell’emisfero cerebrale:
- Ha origine nei gangli spinali. Le fibre originate dai neuroni a T dei gangli spinali penetrano nel midollo spinale come fibre radicolari posteriori -> costituiscono il fascio dorso-laterale del Lissauer a livello della zona marginale del Lissauer e costituiscono il fascio longitudinale del corno posteriore a livello dello strato zonale del Waldeyer. Le fibre di questi due fasci entrano nel corno posteriore del midollo spinale dove in parte vanno direttamente al nucleo della testa del corno posteriore = nucleo proprio del corno posteriore e in parte fanno uno step intermedio nel nucleo della sostanza gelatinosa del Rolando per poi andare anche loro al nucleo della testa del corno posteriore.
- Dal nucleo della testa del corno posteriore originano fibre che si incrociano sulla linea mediana entro la sostanza grigia del midollo spinale e si portano nei cordoni anteriore e laterale eterolaterali dove formano rispettivamente il fascio spino-talamico anteriore che reca la sensibilità tattile protopatica e il fascio spino-talamico laterale che reca la sensibilità termica e dolorifica.
- I fasci spino-talamico anteriore e laterale risalgono il midollo spinale affiancati l’uno all’altro e, insieme al fascio spino-tettale formano il lemnisco spinale.
il lemnisco spinale percorre il midollo allungato, la callotta del ponte e la callotta del mesencefalo: il fascoi spino tettale va nella lamina quadrigemina mentre i fasci spino-talamico anteriore e laterale raggiungono e terminano nel nucleo ventrale posteriore del talamo. - Dal nucleo ventrale posteriore del talamo nascono le fibre talamo-corticali che entrano nella radiazione sensitiva e giungono fino alla corteccia cerebrale dei due terzi superiori della circonvoluzione parietale ascendente, sede dell’area sensitiva primaria (aree 3, 1, 2) (sede della rappresentazione sensitiva somatotopica del tronco e degli arti).
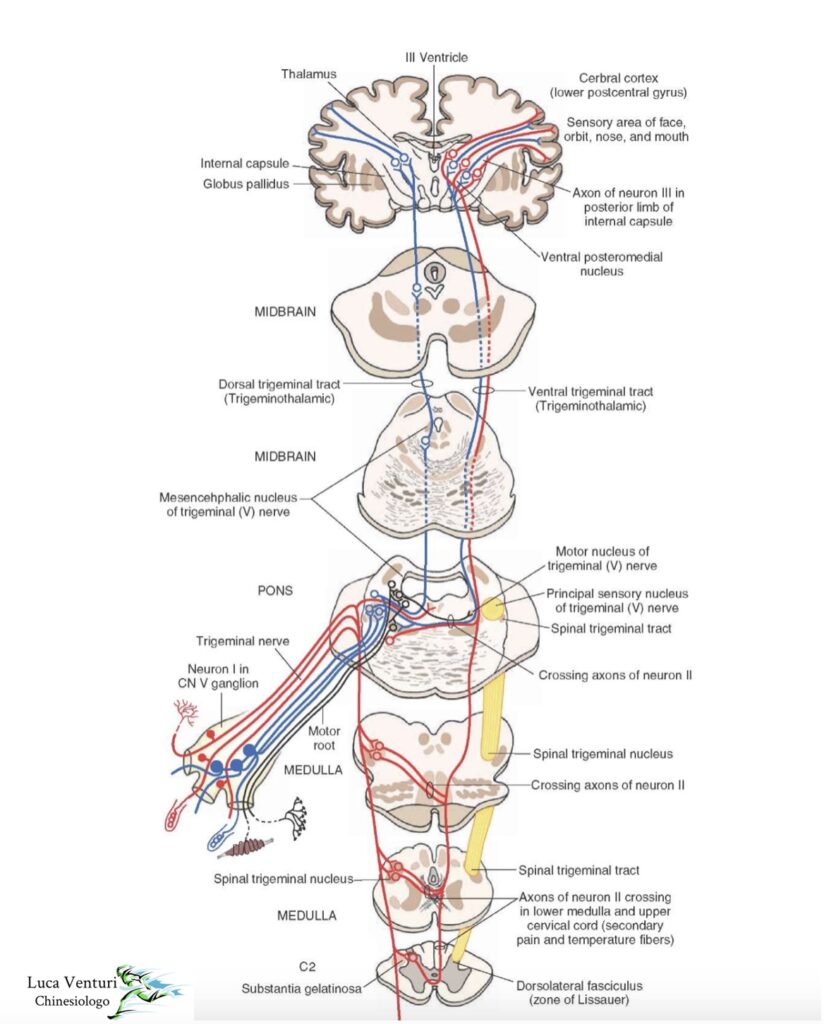
Figura 1: vie sensitive
Studi in merito al ruolo dell’allenamento
Degli studi in passato effettuati sui movimenti locomotori umani suggeriscono che i collegamenti neurali interlimbali spinali e propriospinali nell’uomo quadrupede erano conservati e che questi collegamenti rimangono intatti e fruibili anche dopo l’ictus, per cui è possibile che l’eccitabilità neuronale e la forza muscolare sul lato più colpito possano essere modulate allenando gli arti meno colpiti e attivando le vie neurali intatte sotto il sito della lesione. Gli interventi di riabilitazione e recupero motorio cosiddetti “cross-education” basati sulla forza mostrano grandi guadagni e una modulazione normalizzata dei riflessi nei soggetti con ictus cronico dopo l’allenamento del lato meno colpito. La plasticità neurale spinale è migliorata in prestazioni “Timed Up-and-Go” (TUG ), 10 metri di cammino e test di camminata di 6 minuti, valutate in seguito ad allenamento con il ciclo per le braccia o su ellittica o cyclette. L’adattamento neurale negli arti non allenati insieme a maggiori incrementi percentuali della forza nel programma di cross-education, indicano una plasticità neurale amplificata nei soggetti con ictus cronico rispetto a quella riscontrata in soggetti normali.
Sembra che il sistema nervoso dopo l’ictus rappresenti un terreno fertile per le risposte di allenamento adattato. L’ipotesi è che la plasticità neurale adattiva post ictus sia amplificata in risposta a stimoli di allenamento fisico, rispetto a condizioni di sistema nervoso intatto e non danneggiato. Attivando le connessioni neurali interlimbali che si sono evolute in modo dai nostri antenati quadrupedi, la neuroplasticità amplificata può essere indotta e promuovere la forza e la funzione degli arti non allenati in quelli con ictus cronico. Il concetto centrale è contenuto nella Figura 2, in cui il sistema nervoso è rappresentato come un albero.
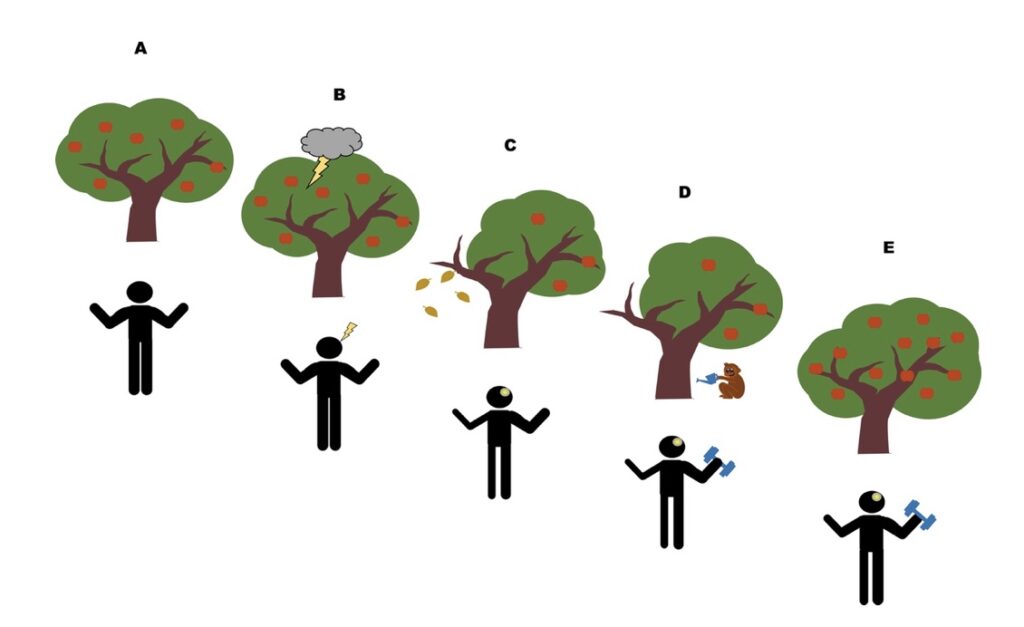
Figura 2: l’albero fiorente rappresenta il sistema nervoso intatto prima della lesione (A). Un fulmine sull’albero provoca rami spezzati e appassiti (B e C). Tuttavia poiché il tronco e la radice rimangono intatti, l’irrigazione continua e la concimazione dell’albero, aiutano i rami appassiti a ricrescere (D ed E). Nel sistema nervoso, la forza degli arti contro – lesionati si riduce drasticamente nei primi mesi dopo la lesione (C). Tuttavia unendo le reti neurali inter – limbali conservate dai nostri antenati quadrupedi (rappresentate dalla scimmia che innaffia l’albero), la plasticità neurale può essere indotta in tutto il corpo anche anni dopo la lesione (D ed E).
Plasticità neurale nell’allenamento di forza post ictus: guadagno bilaterale di forza attraverso l’allenamento unilaterale
Rispetto ai soggetti neurologicamente sani, nelle persone con ictus si riscontrano un maggiore miglioramento della forza e una significativa plasticità neurale dopo vari approcci di allenamento. I metodi di allenamento della forza comunemente usati che si concentrano sul lato più colpito includono l’allenamento contro-resistenza progressivo (Progressive Rensistance Training – PRT: allenamento con resistenza progressivamente aumentata, di solito il 70% della forza massima) e terapia del movimento vincolo indotta (allenare ampiamente la parte più colpita con il movimento dell’arto meno colpito che viene limitato del 90% attraverso un’imbragatura nelle ore di veglia).
I vari esperimenti e studi hanno dimostrano che l’allenamento può effettivamente ridurre la spasticità e migliorare efficacemente la forza muscolare nel lato più colpito dopo l’ictus e inoltre, rispetto alla popolazione generale, le revisioni sistematiche sul PRT mostrano grandi effetti (0,98; intervallo di confidenza al 95%, da 0,67 a 1,29) sugli aumenti di forza nei soggetti con ictus, mentre gli effetti sono modesti sulla popolazione in generale (0,68 ; Intervallo di confidenza al 95%, da 0,52 a 0,84) e questo suggerisce che il PRT ha effetti più forti dopo il danno neurologico derivante dall’ictus.
Sebbene i benefici dell’allenamento della forza sul lato più colpito siano stati confermati in molti studi, allenarsi direttamente sul lato più colpito non è sempre possibile ed è difficile iniziare per quei soggetti che soffrono di spasticità e debolezza muscolare e per questo coloro che hanno un certo grado di debolezza asimmetrica e immobilità dopo l’ictus, l’allenamento del lato meno colpito può essere eseguito per aumentare la forza del lato più colpito e migliorare la simmetria. Questa “cross education” (educazione a senso incrociato) descrive l’allenamento dei muscoli su un lato del corpo per migliorare la forza o l’abilità motoria dell’arto non allenato controlaterale.
Da quando è stata descritta per la prima volta da Edward Scripture nel 1894, sono state trovate prove di educazione incrociata dopo l’allenamento della forza nei muscoli degli arti superiori e inferiori; in particolare in una meta-analisi con un totale di 96 studi sull’allenamento, con allenamenti “crosseducation” inclusi, Green e Gabriel hanno riscontrato il 29% di aumento di forza sul lato non allenato in soggetti con ictus, disturbo neuromuscolare e osteoartrosi, che era superiore al 18% in giovani adulti in buona salute e aumentato del 15% in adulti più anziani. Nei soggetti con ictus cronico, Dragert e Zehr hanno riscontrato la forza aumentata del 34% negli arti inferiori allenati e del 31% negli arti inferiori non allenati in 6 settimane di allenamento per la dorsiflessione con il lato meno colpito e 15 su 19 partecipanti hanno mostrato significativi aumenti di forza nel lato non allenato dopo l’allenamento. Al contrario con lo stesso protocollo di allenamento nei soggetti neurologicamente sani con 5 settimane di allenamento unilaterale di dorsi flessione della caviglia si è vista aumentata la forza di dorsi flessione solo del 14,7% e dell’8,4% rispettivamente sulla caviglia allenata e non allenata. Sun e altri hanno riscontrato che 5 settimane di allenamento nell’ictus cronico hanno migliorato la forza di estensione del polso del 42% e del 35% rispettivamente nel lato allenato e non allenato e sono stati mantenuti i miglioramenti riscontrati nel braccio più colpito per almeno 5 settimane dopo l’allenamento. L’aumento medio della forza “cross-education” nei soggetti neurologicamente sani è del 17% (Figura 3)
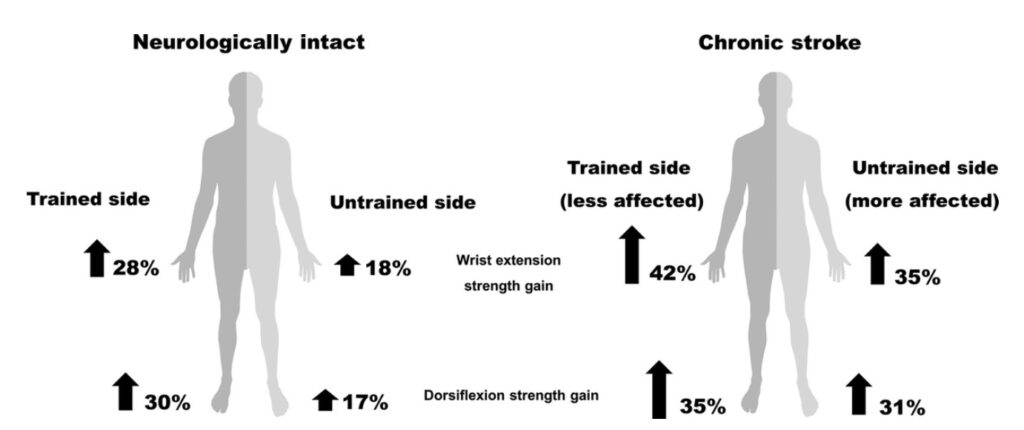
Figura 3: l’estensione unilaterale del polso e l’allenamento della dorsi flessione della caviglia producono aumenti amplificati della forza dopo l’ictus. Rispetto ai neurologicamente sani i partecipanti all’ictus cronico mostrano maggiori guadagni di forza su entrambi i lati allenati (meno colpiti) e non allenati (più colpiti). Le percentuali dell’aumento di forza nei soggetti con ictus cronico sono ottenute dagli studi di Dragert e Zehr e Sun e altri. I dati dei partecipanti neurologicamente sani provengono dalla meta-analisi di Green e Gabriel.
Misurando il cambiamento di forza durante l’allenamento unilaterale dell’impugnatura Barss e altri hanno riscontrato un significativo aumento di forza sul lato non allenato avvenuto intorno alla 15a sessione di allenamento in soggetti neurologicamente sani. Negli studi di Dragert e Zehr e Sun e altri, rispettivamente, sono state eseguite in totale 15 e 18 sessioni di allenamento. Sebbene ci siano solo pochi studi che mostrino attualmente questo effetto incrociato della forza nei soggetti con ictus è evidente che ci sia un aumento della forza maggiore dopo simili dosaggi di allenamento rispetto a soggetti neurologicamente sani, il che suggerisce come la rete neurale post ictus sia in realtà più reattiva agli stimoli dell’allenamento. L’allenamento unilaterale ha alterato anche l’eccitabilità neurale in entrambi i percorsi, spinale e corticospinale, sul lato non allenato. Dragert e Zehr hanno scoperto che la grandezza dell’inibizione reciproca era maggiore con le stesse attività muscolari in entrambi gli arti inferiori, il che suggerisce una ridotta ipereccitabilità dopo l’allenamento. Anche in un altro studio in seguito ad allenamento dell’estensione del polso, la pendenza della linea di regressione tra i riflessi cutanei a latenza precoce e l’lelettromiografia (EMG) di fondo era più ripida sul lato più interessato, indicando che l’eccitabilità della via cutanea si era normalizzata, rispetto a quella riscontrata sul lato meno interessato. La modulazione nelle vie corticali e corticospinali è stata osservata come una ridotta inibizione transcallosale (attraverso il corpo calloso che ha il compito di congiungere i due emisferi cerebrali e permettere lo scambio di informazioni di tipo motorio, sensitivo e cognitivo tra le varie aree, come i tra i lobi del cervello, di queste due importanti masse di tessuto nervoso. Il passaggio di informazioni motorie, sensitive e cognitive tra i due emisferi cerebrali, derivante dalla presenza del corpo calloso, è detto comunicazione interemisferica. Secondariamente, è di supporto al movimento oculare, alla vista, alla gestione dell’attenzione e dell’eccitazione, e alla localizzazione tattile. La scoperta delle funzioni del corpo calloso risale al 1955. Il merito di tale scoperta appartiene a Ronald Myers, un laureato dell’Università di Chicago) e un periodo di silenzio corticale ridotto dal lato controlesionato (Figura 4).
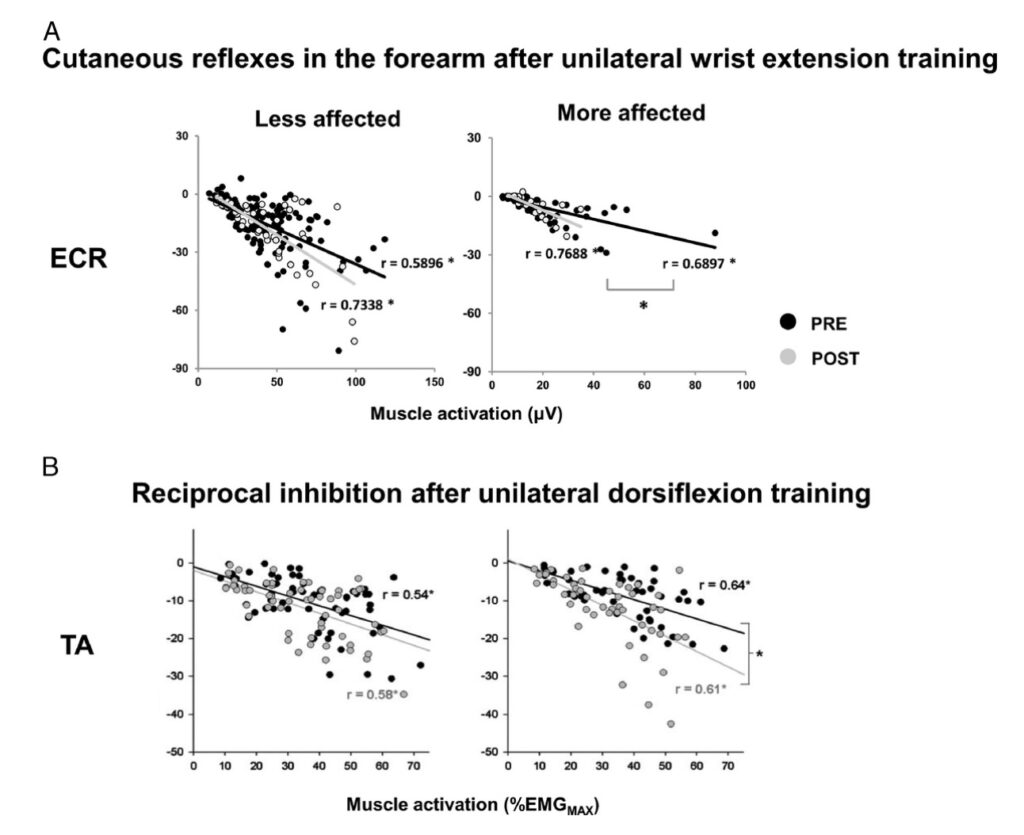
Figura 4: normalizzazione dell’eccitabilità interneuronale spinale dopo allenamento cross-education. A. Riflessi cutanei normalizzati negli estensori carpi radiali (ECR) evocati dalla stimolazione del nervo radiale superficiale (SR) a diversi livelli di attivazione del muscolo di fondo. I punti neri e grigi rappresentano l’ampiezza del riflesso prima dell’allenamento (PRE) e dopo (POST), rispettivamente. B. Inibizione reciproca normalizzata nel muscolo tibiale anteriore (TA). I punti neri e grigi rappresentano le ampiezze riflesse prima dell’allenamento (PRE) e dopo (POST). I dati dei bracci meno colpiti e più colpiti sono mostrati rispettivamente a sinistra e a destra. Sono state eseguite analisi di regressione lineare e sono stati calcolati i valori di Pearson r per ciascuna linea più adatta. * indica una correlazione lineare significativa. # indica una differenza significativa tra le pendenze della regressione lineare. L’asse X rappresenta l’attivazione del muscolo di fondo (% EMGMAX). L’asse Y rappresenta le ampiezze dei riflessi. Dati adattati da (9,10).
La plasticità neurale indotta dall’allenamento “cross-education” è stata trovata in diverse regioni del sistema nervoso nei soggetti sani. Una meta-analisi di Manca e altri ha trovato una riduzione dell’inibizione corticale a breve intervallo e un periodo di silenzio corticale nell’aggregazione dei risultati, il che suggerisce che l’allenamento unilaterale della forza influenza l’inibizione intracorticale e l’eccitabilità GABAergica nella corteccia motoria dell’emisfero non allenato. Ll recettore GABA A (recettore ionotropo) è uno dei due recettori per il GABA (acido γ-amminobutirrico) che sono presenti a livello del sistema nervoso, assieme al recettore GABA B (recettore metabotropo accoppiato alle proteine”G”). È un canale per il cloro presente a livello postsinaptico in molti neuroni. Il canale è formato da diverse subunità, leggermente diverse a seconda del distretto nervoso in cui si trova, distinte tra α (da 1 a 6), β (1-4), γ (1-3), δ, ε. L’associazione più comune è formata da 2 subunità α, 2 subunità β e 1 subunità γ. Il GABA è un agonista endogeno del recettore e si lega prevalentemente ad un sito posto sulla subunità beta, mediando una modificazione allosterica che fa aprire il canale per il cloro. Esistono molti agonisti ed antagonisti del recettore GABA A, che si legano alle diverse subunità. Ad altri siti, presenti sempre nella struttura del recettore, si legano invece altri composti quali i barbiturici, i neurosteroidi (allopregnanolone), gli anestetici generali endovenosi ed etanolo. GABAergico significa letteralmente “che riguarda o che coinvolge il neurotrasmettitore GABA”. Così, una sinapsi è GABAergica se utilizza il GABA come neurotrasmettitore e un neurone si dice GABAergico se produce GABA. Una sostanza, anche non endogena, è GABAergica se produce qualche effetto grazie a delle interazione con il sistema GABAergico, per esempio stimolando o inibendo la trasmissione del neurotrasmettitore GABA.
Nei soggetti con ictus cronico, la plasticità neurale non è stata osservata in questi due percorsi corticospinali, ma i cambiamenti nei riflessi spinali mediati e nei percorsi di inibizione transcallosale suggeriscono che è possibile indurre un aumento della forza bilaterale e l’adattamento plastico nei restanti percorsi neurali intatti. La plasticità neurale spinale è stata osservata dopo l’allenamento della forza usando i muscoli della caviglia e del polso in soggetti con ictus e pertanto è probabile che le connessioni neurali interlimbali a livello spinale siano coinvolte nella mediazione della cross education della forza dopo la lesione sopraspinale.
Con tutti i vantaggi dell’allenamento unilaterale della forza nell’aumento della forza bilaterale e nella plasticità neurale, l’allenamento della forza attraverso l’educazione incrociata dovrebbe essere considerato complementare agli approcci di allenamento tradizionali incentrati sul miglioramento funzionale della parte più colpita. Il concetto di allenamento della parte meno colpita potrebbe essere usato per “aumentare” la forza del lato più colpito quando la debolezza muscolare impedisce l’allenamento diretto e successivamente alla riacquisizione di forza nella parte più colpita, l’allenamento funzionale dovrebbe essere focalizzato sulla parte più colpita.
Plasticità neurale nell’allenamento locomotorio post ictus: gli arti superiori possono dare una mano a quelli inferiori
Un input discendente ridotto influisce sulla funzione di camminata e sulla qualità della vita post ictus. Precedenti studi suggeriscono che arti superiori e arti inferiori condividono comuni elementi di controllo neurale durante movimenti ritmici come camminare e andare in bicicletta. Utilizzando questa comune connessione neurale interlimbica, le funzioni di deambulazione possono essere facilitate da altri movimenti ritmici come il movimento ciclico degli arti superiori (A.S.) o di A.S. e arti inferiori (A.I.) dopo la lesione.
Forti legami neurali e meccanici tra arti superiori e inferiori sono stati osservati nell’uomo durante la locomozione, sebbene gli arti superiori svolgano ruoli meno diretti nella propulsione durante la deambulazione. Oltre a stabilizzare il busto dalla rotazione, i movimenti ritmici dell’arto superiore regolano anche l’eccitabilità del midollo spinale lombare e l’attivazione muscolare degli A.I. Huang e Ferris hanno studiato l’accoppiamento neurale tra gli arti superiori e inferiori quando i soggetti si sono esercitati su uno stepper reclinato in cui i movimenti di arti superiori ed inferiori erano accoppiati meccanicamente. I movimenti di A.S. durante il passo hanno migliorato l’attività muscolare degli A.I. e questi effetti facilitativi sono aumentati quando gli A.S. si sono mossi contro una maggiore resistenza o ad una frequenza più alta. L’accoppiamento neurale tra A.S. e A.I. è stato trovato anche in altri compiti ritmici, come camminare e pedalare, con significativi riflessi fase-dipendenti nei muscoli degli A.I. evocati dalla stimolazione sensoriale degli A.S.
Dopo l’ictus vengono mantenute le connessioni neurali interlimbali tra A.S. e A.I. Una singola sessione di allenamento con un A.S. può alterare l’eccitabilità spinale degli A.I. Tali connessioni neurali possono essere applicate nella riabilitazione della locomozione incorporando movimenti ritmici di entrambi i compartimenti. Klarner e altri hanno scoperto che 6 settimane di allenamento moderato di cycle per A.S. e A.I. in soggetti con ictus hanno aumentato la forza e il range di movimento nella caviglia più colpita. Inoltre durante la deambulazione sono state osservate modulazioni fase-dipendente dell’attivazione della muscolatura degli arti inferiori e dei riflessi cutanei, indicando che la regolazione della rete neurale interlimbale è normalizzata allo stato neurologicamente sano. Poiché l’intensità dell’esercizio era moderata (i soggetti hanno riportato un tasso di sforzo percepito tra 3 e 5), la plasticità neurale indotta dall’allenamento e il guadagno funzionale sono principalmente dovuti al movimento ritmico interlimbale attivo. Sebbene la camminata non sia stata allenata direttamente e i partecipanti fossero seduti durante tutte le sessioni di allenamento, l’allenamento ciclistico combinato può trasferirsi al miglioramento delle prestazioni di camminata e ciò supporta l’ipotesi che i movimenti ritmici siano regolati da reti neurali centrali comuni.
Il potere dei movimenti ritmici ciclici nell’amplificare l’attivazione dei muscoli degli A.I. e la capacità di camminare è ulteriormente confermato da uno studio di Kaupp e altri, in cui i soggetti hanno eseguito solo l’esercizio con 1 A.S. per 5 settimane, 3 volte a settimana per 30 minuti e sono stati riscontrati miglioramenti significativi in soggetti con ictus cronico nei test “Timed Up-and-Go, con ictus, 10 metri e camminata di 6 minuti. Inoltre nel gesto ciclico con 1 A.S. è stato ottenuto un aumento dell’attivazione del muscolo tibiale anteriore sul lato più interessato e i riflessi cutanei normalizzati in entrambe gli A.I. (Figura 5). Tale adattamento neurale è importante per aiutare una debole dorsiflessione e per migliorarne l’efficienza, per prevenire l’inciampo o cadere dopo l’ictus. Risultati simili sono stati recentemente dimostrati in seguito ad allenamento con ciclo di 1 A.S. in una lesione incompleta del midollo spinale .
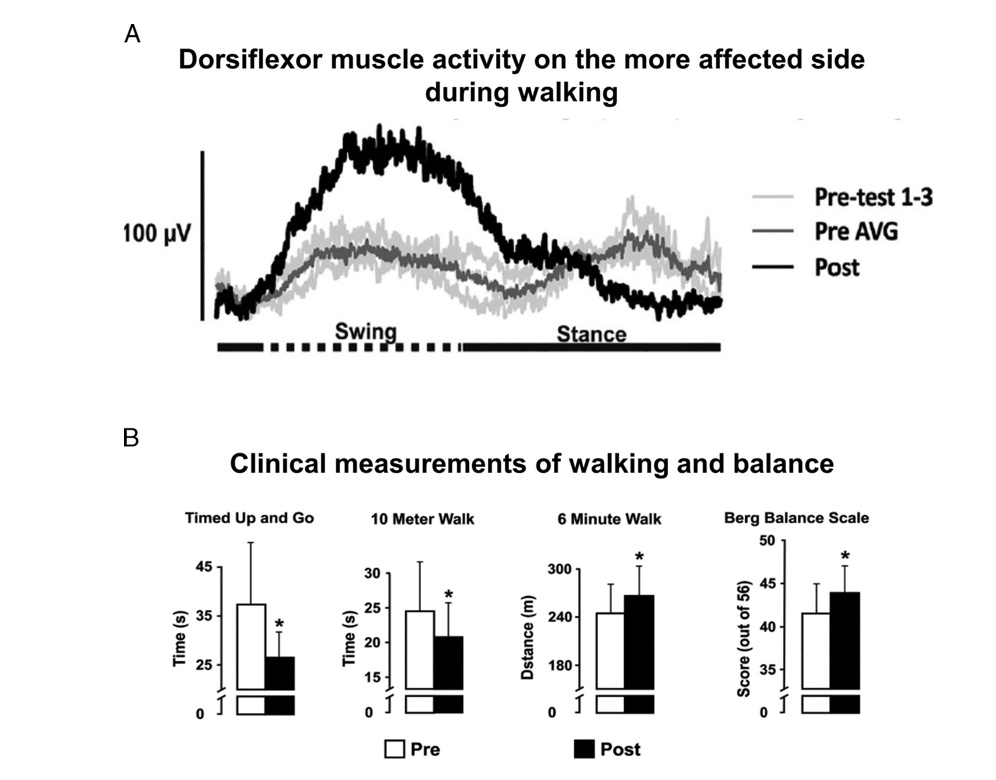
Figura 4: attività muscolare tibiale anteriore normalizzata e prestazioni di camminata dopo l’allenamento di cycle di 1 A.S. durante l’ictus A. Registrazioni EMG del muscolo tibiale anteriore (TA) sul lato più interessato da un partecipante. Le tracce grigio chiaro rappresentano il prima dell’allenamento, con la traccia grigio scuro che indica la media non allenata e la traccia nera è il risultato dopo l’allenamento. B. Miglioramento delle prestazioni nei test di deambulazione e di equilibrio. Dati di allenamento prima (barre aperte) e dopo (barre piene) del gruppo per “Timed Up and Go”, camminata di 10 metri, camminata di 6 minuti e bilancia di Berg.
Nella locomozione quadrupededica tutti e quattro gli arti sono direttamente coinvolti nella locomozione e nella produzione di forza propulsiva; la lesione a un arto di solito compromette, ma non impedisce la locomozione. In tali casi i restanti tre arti sani sono sottoposti a stress d’allenamento per un aumento del carico e dell’uso forzato. Il forte accoppiamento interilmbico neurale e biomeccanico consentirebbe agli animali quadrupedi di continuare comportamenti come la caccia o la fuga dai predatori, mentre guarisce l’arto lesionato. L’uso attivo dell’arto non infortunato può attingere ai circuiti che sono alla base degli effetti dell’educazione incrociata e può portare ad un recupero più rapido della funzione dell’arto lesionato.
Senza alcuna lesione o danno neurale, l’attività delle reti neurali interlimbici tra tutti e quattro gli arti negli esseri umani bipedi è subliminale e sembra meno ovvia, perché possiamo facilmente svolgere compiti motori univoci o bimanuali indipendenti. Tuttavia il sistema nervoso umano condivide molte somiglianze con gli animali quadrupedi nella regolazione dei movimenti interlimbici e considerando l’interazione neuromeccanica interlimbica durante la locomozione, da una prospettiva evolutiva, prove sostanziali mostrano che i meccanismi di controllo neurale nei movimenti ritmici come camminare, correre e andare in bicicletta nell’uomo sono simili a quelli degli animali quadrupedi. I movimenti interlimbici coordinati durante la locomozione sono regolati dalle stesse reti neurali spinali (generatore di pattern centrale) sia per gli esseri umani, che per gli altri animali quadrupedi. Va notato che la modulazione neurale interlimbica umana non è solo preservata tra gli A.I. per regolare la locomozione, ma esiste anche tra gli A.S e A.I., così come il lato ipsilaterale e controlaterale durante le attività non locomotorie. Ad esempio la stimolazione sensoriale all’A.S. durante la deambulazione o il movimento ritmico dell’A.S. influisce sull’eccitabilità spinale per i muscoli degli A.I., come dimostrato dall’alterazione del riflesso H e delle ampiezze del riflesso cutaneo. L’allenamento del movimento o della forza su un lato del corpo può anche modificare l’ampiezza del riflesso H e della reciproca inibizione sul lato controlaterale. Il riflesso H è un potenziale d’azione motorio ottenuto dalla stimolazione ortodromica (con percorso più breve) di fibre sensitive, che contraggono sinapsi a livello midollare, attivano il pool motoneuronale e ritornano attraverso fibre motorie. La risposta viene ottenuta da un riflesso monosinaptico midollare (riflesso di Hoffman) che si riscontra nell’adulto sano nei muscoli Gastrocnemio e Flessore Radiale del Carpo.
Dopo l’ictus, il danno neurale influisce sulle eccitabilità delle vie corticale e corticospinale associate alla lesione. Tuttavia i circuiti neuronali al di sotto del sito della lesione, inclusi i percorsi reticolari, propriospinali e altre vie neurali spinali, sono di solito morfologicamente intatti. Gli studi su soggetti con lesioni del midollo spinale e su animali decerebrati hanno fornito prove convincenti che il movimento interlimbico può essere modulato dalla rete neurale. Con un input discendente ridotto dopo l’ictus, le restanti vie neurali morfologicamente sane svolgono un ruolo più difficile nella regolazione dei movimenti e nella situazione di facilitare il recupero neurale. Le prove da modelli animali mostrano percorsi reticolospinali e propriospinali che asserviscono alcuni dei recuperi funzionali e regolano la coordinazione interlimbica dopo la lesione corticospinale.
Dopo l’ictus, sia l’allenamento di forza “cross-education” che l’allenamento con l’A.S. si collegano alle restanti reti neurali interlimbiche allenandosi attivamente con gli arti meno colpiti. Il fatto che l’eccitabilità spinale possa essere modificata attraverso questi metodi di allenamento nei partecipanti a ictus cronico conferma il contributo della rete neurale interlimbica nel mediare la forza indotta dall’allenamento e il miglioramento funzionale. In modo simile a un quadrupede nell’affrontare l’arto leso affidandosi maggiormente agli arti non influenzati, l’attivazione sull’arto meno colpito dall’ictus serve come stimolo all’allenamento che porta a un miglioramento della funzione dopo lesione senza coinvolgere direttamente i muscoli bersaglio.
Un esperimento avvincente, recente e pertinente che utilizzava un modello murino (di topi) prevedeva la mappatura dell’area del re-innervazione della sostanza grigia cervicale mediante la germinazione di assoni cortico – spinali contro lesionati a una lesione da ictus creata dalla fototrombosi. La conclusione di questo lavoro è stata che la materia grigia spinale che si è degenerata a causa della lesione corticale “rappresenta un ambiente che favorisce la crescita per la germinazione delle fibre corticospinali originate dalla corteccia motoria contro lesionata” e se tali processi dovessero rivelarsi anche nell’uomo, questo potrebbe spiegare gran parte della risposta neuropatica dell’allenamento che è amplificata dopo l’ictus.
Jon Wolpaw ha proposto un modello di “equilibrio contrattato” per spiegare la plasticità spinale indotta dall’attività riscontrata in studi su piccoli animali e umani. Questo modello sottolinea che la plasticità nel cervello induce e mantiene quella nel midollo spinale. La plasticità del cervello e del midollo spinale si combinano per produrre e preservare prestazioni soddisfacenti definendo una serie di caratteristiche chiave per ciascun comportamento. Una previsione di questo modello è “se la plasticità spinale che produce un nuovo comportamento migliora anche un vecchio comportamento, è probabile che l’entità di questa plasticità venga migliorata perché sarà guidata da due dei partecipanti alla negoziazione, il nuovo comportamento e quello vecchio”.
Conclusione
Per i soggetti affetti da ictus cronico e difficoltà ad accedere e ricevere l’allenamento di forza o locomozione a causa della mancanza di forza muscolare e coordinazione nella parte più colpita, la cross education, il cycle con A.S. e l’esercizio con A.S. e A.I., forniscono delle tipologie di allenamento facilmente applicabili per aumentare la forza e la funzionalità degli arti più colpiti. Presi insieme ad altre modalità di allenamento riabilitativo, i metodi di recupero che coinvolgono il maggior numero possibile di arti possono aiutare a raggiungere la forza continua così da raggiungere il miglioramento funzionale.
Tratto: Training-Induced Neural Plasticity and Strength Are Amplified After Stroke” Sun, Yao; Zehr, E. Paul – Exercise and Sport Sciences Reviews: October 2019 – Volume 47 – Issue 4 – p 223-229
