Dopo l’infarto del miocardio (IM), i risultati circa il favorevole rimodellamento ventricolare sono scarsi per un aumentato rischio di disfunzione ventricolare, per cui le strategie e le azioni per attenuare questo processo sono strumenti fondamentali nella gestione dei soggetti con occlusione coronarica, tra cui terapia di riperfusione, beta-bloccanti e inibitori del sistema renina-angiotensina. L’allenamento è stato introdotto in ritardo, dopo essere stato accettato come strategia di rimodellamento post IM, ma resta da chiarire il momento migliore per iniziare un programma di allenamento dopo un’occlusione coronarica. In effetti durante la fase di guarigione, numerosi fattori possono stimolare la dilatazione progressiva del cuore aumentando lo stress della parete ventricolare. È importante sottolineare che s’ipotizza che l’esercizio precoce possa agire come un fattore di stress parietale, aumentando le dimensioni del ventricolo sinistro. Il processo di rimodellamento inizia molto presto dopo l’occlusione coronarica, per cui le strategie avviate in anticipo potrebbero avere maggiori ripercussioni nella mitigazione del rimodellamento ventricolare dopo IM e negli ultimi anni sono state introdotte nuove modalità di esercizio fisico, con diverse modulazioni e risultati promettenti, incluso l’interval training. È importante sottolineare che non è noto se la modalità e l’intensità dell’allenamento precoce, dopo l’IM, possano influenzare il processo di rimodellamento; anche se un studio precedente ha mostrato come un esercizio ritardato potrebbe essere migliore di un esercizio precoce dopo l’occlusione coronarica.
Lo studio sperimentale
Lo studio è stato condotto su ratti maschi, del peso di 200-250 g, selezionati solo se con una dimensione d’infarto superiore al 35%, valutato dall’analisi istologica, perché i ricercatori hanno considerato che gli animali con piccola dimensione d’infarto non sono sottoposti a rimodellamento cardiaco.
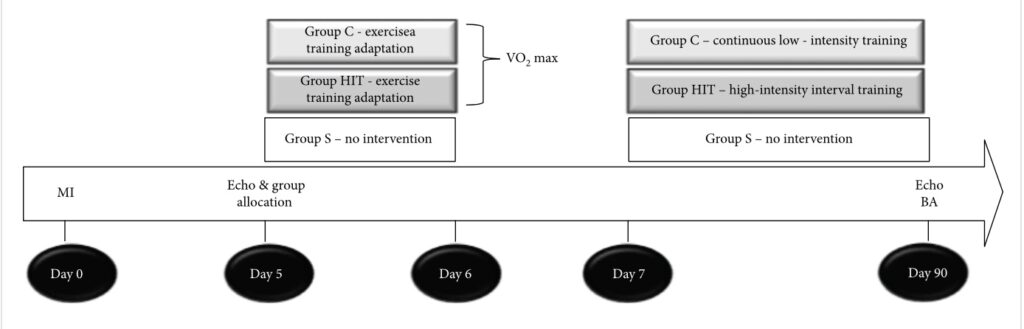
Figura 1: cronologia. MI: infarto miocardico; echo: ecocardiogramma; VO2 max: massimo consumo di ossigeno; BA: analisi biochimica.
Dopo 5 giorni di esecuzione della procedura chirurgica d’induzione dell’infarto è stato condotto uno studio ecocardiografico iniziale di valutazione sistolica e diastolica, i cambiamenti della frazione d’eiezione e la dimensione dell’infarto, per garantire l’omogeneità tra i gruppi. Dopo tale studio ecocardiografico gli animali sono stati assegnati in tre gruppi sperimentali e osservati per tre mesi: S (animali di controllo sedentario), C (animali sottoposti a addestramento continuo a bassa intensità) e HIIT (animali sottoposti a addestramento ad intervalli ad alta intensità). I protocolli di allenamento sono iniziati 5 giorni dopo le procedure chirurgiche. La velocità è iniziata a 6 m/min ed è stata aumentata di 3m/min ogni 3 minuti fino a quando i ratti non potevano più correre. Lo stesso protocollo è stato utilizzato anche per misurare il massimo consumo di ossigeno (VO2 max). Gli animali sono stati collocati all’interno di una camera metabolica (con un flusso d’aria all’interno della camera di 3.500 ml/min).
- L’allenamento con esercizi a bassa intensità è stato eseguito con una velocità del tapis roulant corrispondente al 40% del VO2max, che è stato mantenuto invariato per l’intera sessione.
- L’allenamento ad intervalli ad alta intensità (HIIT) è stato eseguito in modo tale che i ratti corressero per 3 minuti al 60% del VO2mX, seguiti da intervalli di 4 minuti all’85% del VO2max, che è stato ripetuto sette volte, quindi ogni sessione HIIT è durata per 50 minuti.
- I protocolli continui a bassa intensità e HIIT avevano un volume corrispondente, il che significa che le distanze totali di corsa in ogni sessione di allenamento continuo a bassa intensità o HIIT erano identiche. I protocolli sono stati eseguiti con un’inclinazione di 15°, 5 giorni a settimana, per 3 mesi.
Alla fine del follow-up di tre mesi, è stata eseguita l’ecocardiografia e le strutture cardiache sono state misurate secondo i metodi precedenti, così come le procedure e le misurazioni per valutare la funzione ventricolare sinistra sono state eseguite seguendo un metodo precedentemente descritto. Le attività di lattato deidrogenasi (LDH), citrato sintasi, β-idrossiacil-CoA deidrogenasi (β-OH-acil-CoADH), fosfofructochinasi (PFK), piruvato deidrogenasi complesso (PI-DH), NADH deidrogenasi (complesso I), la succinato deidrogenasi (complesso II) e l’ATP sintasi sono state misurate anch’esse. Lo stress ossidativo è stato valutato determinando la concentrazione di idrossido di lipidi (LH). Le attività di glutatione perossidasi (GSH-Px) e catalasi (CAT) sono state valutate.
Sono stati sottoposti all’occlusione coronarica e al test 140 animali. Dopo 5 giorni sono morti 50 ratti. Inoltre, 20 animali sono stati scartati perché hanno subito una dimensione dell’infarto <35%. Pertanto i gruppi erano composti dai seguenti animali: S=25, C=25 e HIIT= 22.
Non ci sono state differenze nel peso corporeo tra i gruppi all’inizio dell’esperimento dopo 3 mesi e nemmeno nella dimensione dell’infarto tra i gruppi. Allo stesso modo, nel periodo di 3 mesi dopo l’infarto, non vi è stata alcuna differenza nella mortalità tra i gruppi (S=10, C=7 e HIIT=7).
Discussione
L’obiettivo di questo studio è stato quello di analizzare l’impatto delle diverse modalità e intensità dell’allenamento sul rimodellamento cardiaco iniziato subito dopo l’IM provocato sperimentalmente. I dati dello studio hanno mostrato che sia HIIT, che la modalità continua a bassa intensità hanno migliorato le variabili del metabolismo energetico cardiaco rispetto agli animali sedentari infartuati. Inoltre HIIT ha ridotto lo stress ossidativo cardiaco, associato ad una migliore funzionalità diastolica, mentre il gruppo di sottoposto ad esercizio continuo a bassa intensità ha mostrato una compromissione della funzione cardiaca. Come discusso in precedenza, gli effetti benefici dell’allenamento fisico tardivo dopo l’IM sono indiscutibili e d’altra parte, quando l’esercizio fisico inizia subito dopo l’occlusione coronarica, i risultati nel processo di rimodellamento non sono così uniformi. Nei ratti con grandi infarti della parete anteriore, l’esercizio fisico è iniziato meno di una settimana dopo che l’occlusione coronarica ha provocato un aumento dell’espansione dell’infarto con la dilatazione della cavità ventricolare sinistra. Gli autori hanno ipotizzato che l’esercizio fisico precoce potesse aumentare lo stress parietale e stimolare il processo di rimodellamento, ma al contrario, nei topi e nei ratti, l’esercizio fisico non intenso iniziato una settimana dopo l’infarto ha attenuato il processo di rimodellamento o non ha avuto ripercussioni morfologiche. Pertanto gli autori ne traggono che gli effetti dell’esercizio fisico dopo l’infarto dipendono da diverse variabili, inclusa la dimensione dell’infarto e dal protocollo di esercizio utilizzato. È importante sottolineare che il ruolo della modalità e dell’intensità dell’allenamento precoce nel rimodellamento ventricolare dopo infarto miocardico rimane da chiarire.
Tale studio ha dimostrato che HIIT ha migliorato la funzionalità diastolica e il gruppo continuo a bassa intensità ha mostrato una compromissione della funzione cardiaca, valutata dall’indice TEI (è un indice che incorpora intervalli di tempo sia sistolico che diastolico nell’esprimere la funzione ventricolare sistolica e diastolica globale. La disfunzione sistolica prolunga la pre-eiezione, il tempo di contrazione isovolumica, IVCT e una riduzione del tempo di eiezione, ET. Sia la disfunzione sistolica che quella diastolica determinano un’anomalia nel rilassamento miocardico che prolunga il periodo di rilassamento, ossia il tempo di rilassamento isovolumico, IVRT) e dal rapporto IRT/RR0.5 (il tempo di rilassamento isovolumetrico normalizzato alla frequenza cardiaca) e l’onda, valutate dall’ecocardiogramma tissutale. È importante sottolineare che l’esercizio precoce dopo l’IM non ha migliorato la funzionalità sistolica. Gli effetti benefici dell’esercizio fisico iniziato in ritardo dopo l’infarto sperimentale si basano su ampi consensi, inclusa una migliore funzionalità sistolica. Pertanto i dati dello studio rafforzano il concetto che, almeno finora, i protocolli di esercizio fisico tardivo dopo l’infarto potrebbero essere migliori dell’esercizio fisico precoce, indipendentemente dalla modalità o intensità.
Il ROS, ovvero Reactive Oxygene Species [indica i prodotti intermedi dei processi cellulari di riduzione dell’ossigeno, come superossidi, perossidi d’idrogeno, radicali ossidrili e i perossidi derivanti dall’addizione dell’ossigeno ai radicali degli acidi grassi delle membrane. Nei Procarioti, i ROS hanno effetti diretti sulla trascrizione genica perché i fattori di trascrizione contengono essi stessi un elemento ROS-sensibile, come gruppi di cisteine ridotte o centri ferro-zolfo, costituiti da un atomo di ferro al centro di un complesso di zolfi sulfidrilici. Negli Eucarioti, invece, l’espressione genica è più spesso controllata dai ROS in maniera indiretta e complessa, a causa dei diversi compartimenti cellulari che concorrono alle fasi successive d’induzione e di esecuzione del processo di attivazione dei geni e che possono avere omeostasi ossido-riduttive differenti. Oggi, accanto ai ROS, va aggiunta una nuova famiglia di specie radicaliche, caratterizzate dalla presenza, oltre che dell’ossigeno, di un atomo d’azoto e pertanto indicate come RNS, (Reactive Nitrogen Species). ROS e RNS interagiscono fra loro in vario modo. Oggi sappiamo che intervalli molto stretti nel flusso di ROS e RNS possono indirizzare il ciclo cellulare verso la sua attivazione o il suo arresto, attraverso la modificazione ossidativa di cisteine presenti nelle proteine che si intercalano fra la fonte primaria di radicali e le MAPK (Mitogen-activated protein kinase). Queste reazioni sono quindi molto importanti nel determinare l’accelerazione della riproduzione cellulare (proliferazione), come nello sviluppo degli organismi e nella carcinogenesi o per converso il suo rallentamento, come nell’invecchiamento e nella morte cellulare programmata o apoptosi] e lo stress ossidativo svolgono un ruolo critico nel rimodellamento cardiaco a seguito di diverse lesioni cardiache. Per proteggere dallo stress ossidativo un sistema ben organizzato di antiossidanti funziona in modo coordinato e in questo studio, entrambe le modalità aumentano gli enzimi antiossidanti, ma solo il protocollo HIIT ha ridotto lo stress ossidativo, per cui, considerando il sistema redox, possiamo l’HIIT è stato superiore all’allenamento continuo a bassa intensità.
Un altro potenziale meccanismo coinvolto nell’azione di allenamento sul rimodellamento cardiaco è legato al metabolismo energetico cardiaco. Il cuore rimodellato mostra diversi cambiamenti nel metabolismo energetico, tra cui uno spostamento delle preferenze di carburante, una riduzione della quantità di carburante, anomalie mitocondriali e un trasporto ridotto di energia dai mitocondri al sito di utilizzazione. I dati sul metabolismo energetico suggeriscono che, nonostante non vi siano differenze specifiche, l’HIIT ha aumentato l’attività del substrato energetico e la fosforilazione mitocondriale in modo più evidente dell’allenamento continuo a bassa intensità, anche se gli evidenti benefici dello stress ossidativo e del metabolismo di energia cardiaca nel gruppo di HIIT non hanno portato a un miglioramento della funzione sistolica, che è una variabile critica nella valutazione del rimodellamento cardiaco. Tuttavia l’evoluzione temporale del processo di rimodellamento potrebbe spiegare questi risultati apparentemente discordanti e in effetti, il primo evento in questo processo è uno stimolo al cuore, tra cui sovraccarico emodinamico, perdita di miociti, infiammazione cardiaca, alterazioni genetiche e lesioni tossiche. Questo fenomeno, a sua volta, provoca deleterie risposte cardiache in diversi percorsi, tra cui sistemi infiammatori, morte cellulare, accumulo di collagene, deficit del metabolismo energetico e stress ossidativo. Infine, a seguito di questi eventi, il processo di rimodellamento è associato a cambiamenti nelle variabili morfologiche e funzionali cardiache.
Pertanto gli autori concludono che con un tempo di follow-up più lungo, i benefici cambiamenti biochimici indotti dall’HIIT provochino un miglioramento funzionale sistolico cardiaco. HIIT dunque ha ridotto lo stress ossidativo cardiaco, associato a una migliore funzionalità diastolica, mentre il gruppo di allenamento continuo a bassa intensità ha mostrato una compromissione della funzione cardiaca. Pertanto, nel complesso, i dati dei dello studio suggeriscono che l’HIIT potrebbe essere la migliore modalità per impostare l’esercizio fisico precoce dopo l’IM e dovrebbe essere meglio studiato in questo scenario clinico.
Tratto da: Batista F.D. Furlan Polegato B., Da Silva R.C., Claro R.T., Shmidt Azevedo P., Fernandes A.A., Okoshi K., Rupp de Paiva S.A., Ferreira Minicucci M. and Mamede Zornorff L.A., Impact of Modality and Intensity of Early Exercise Training on Ventricular Remodeling after Myocardial Infarction. Oxidative Stress and Heart Failure: Mechanisms, Signalling Pathways, and Therapeutics, Research Article Open Access Hindawi, 20 Luglio 2020.
