Contrazioni intense e ripetute del muscolo scheletrico possono portare a una riduzione temporanea della capacità del muscolo di generare forza (1). Questa condizione, nota come affaticamento muscolare, può verificarsi durante l’intero esercizio fisico, come nel ciclismo, così come durante un compito muscolare isolato, come inspirare contro resistenza (2,3). L’entità specifica individuale di affaticamento muscolare è stata dimostrata alla fine dell’esercizio ad alta intensità, suggerendo che esiste una “soglia critica” di fatica che limita le prestazioni all’esercizio (2,4,5). Sembra che per prevenire i il superamento di questa soglia critica da parte dei muscoli locomotori, diminuisca l’uscita motoneuronale [stimata attraverso l’elettromiografia di superficie (EMG) del muscoli locomotori] e la produzione di energia durante l’esercizio respiratorio (2,6,7). Il sistema nervoso centrale regola la produzione motoneuronale, in parte, elaborando il feedback da neuroni afferenti del gruppo III/IV che sono sensibili agli stimoli meccanici e metabolici dell’apparato muscolare locomotorio, in grado di limitare la perturbazione metabolica intramuscolare a un limite tollerabile (6,8). Infatti alterazioni specifiche nei metaboliti intramuscolari, come l’adenosina difosfato, ioni idrogeno e fosfato inorganico e fosfocreatina sono presenti alla fine di un esercizio ad alta intensità (6,9,10).
L’uscita motoneuronale, la potenza in uscita e grandezza dell’affaticamento dei muscoli locomotori può anche essere influenzata dal feedback sensoriale dai muscoli precedentemente esercitati. Ad esempio, il tempo all’esaurimento e la quantità di affaticamento periferico sono stati ridotti dopo un ciclo di carico costante che è stato preceduto dall’esercizio di avviamento del braccio (11). Allo stesso modo, l’esecuzione di estensioni del ginocchio su una gamba in una gamba dopo aver esercitato la gamba controlaterale fino al fallimento del compito ha ridotto il tempo all’esaurimento e ridotto l’entità dell’affaticamento periferico rispetto a nessun esercizio precedente della gamba (12). Questi risultati supportano l’idea di un “limite di tolleranza sensoriale” in base al quale il feedback sensoriale proveniente dai muscoli precedentemente esercitati si combina con il feedback sensoriale originato dai muscoli che eseguono il compito di prestazione e questa combinazione supera una soglia sensoriale globale (1,13) . Il superamento di questo limite sensoriale provoca il fallimento del compito senza il raggiungimento di un livello critico di affaticamento dei muscoli locomotori. Questo concetto illustra la natura integrativa delle limitazioni alla prestazione fisica in quanto il feedback globale da più fonti è combinato per determinare l’uscita motoneuronale, piuttosto che solo il feedback dai muscoli locomotori. Una fonte importante di feedback sensoriale durante l’esercizio è il sistema respiratorio, che è noto per contribuire in limitazioni e stanchezza all’esercizio, sia dal punto di vista fisiologico, che percettivo (14).
Se il feedback sensoriale del sistema respiratorio non corrisponde all’output motoneuronale respiratorio, può verificarsi dispnea, che può contribuire al raggiungimento di un limite di tolleranza sensoriale. Un approccio interessante per comprendere il ruolo del sistema respiratorio nella regolazione della prestazione fisica, così come la sua influenza sulla percezione della dispnea e dell’affaticamento dei muscoli locomotori, è quello di indurre l’affaticamento dei muscoli respiratori (RMF) prima dell’esercizio. Sebbene alcuni studi abbiano valutato l’effetto di un precedente lavoro sui muscoli respiratori sulla prestazione fisica, i dati sono equivoci (15-19). Le differenze nei metodi utilizzati per indurre RMF e/o differenze nel protocollo utilizzato per valutare le prestazioni dell’esercizio possono spiegare i risultati discrepanti. Per quanto riguarda quest’ultimo, alcuni studi hanno utilizzato l’esercizio di ciclismo a carico costante per indagare gli effetti di RMF preesistente (19) o modifiche al lavoro di respirazione (20) sulla fatica periferica e sulla tolleranza all’esercizio. Sebbene l’uso dell’esercizio a carico costante sia vantaggioso per il confronto di specifiche variabili fisiologiche, di per sé, non consente un esame di come le alterazioni della percezione dello sforzo (per esempio, valutazioni della dispnea) potrebbero alterare l’autoregolazione della potenza erogata durante un’attività di prestazione fisica.
Pertanto lo scopo di questo studio è stato quello di determinare se l’RMF preesistente alterasse le prestazioni dell’esercizio, l’uscita motoneuronale stimata attraverso l’EMG di superficie e lo sviluppo dell’affaticamento muscolare locomotore, durante una prova a cronometro di auto apprendimento in cui la potenza potesse essere liberamente modificata dal soggetto. Gli autori hanno ipotizzato che il preesistente RMF peggiorerebbe le prestazioni del ciclismo, ridurrebbe la produzione motoneuronale e ridurrebbe l’entità dell’affaticamento muscolare locomotore dopo l’esercizio.
Metodi
Soggetti
Otto ciclisti maschi sani e allenati (età, 22 ± 4 anni; altezza, 185 ± 6 cm; massa corporea, 78 ± 9 kg; capacità vitale forzata (FVC), 6,2 ± 1,0 L; volume espiratorio forzato in 1 s (FEV1), 5,0 ± 0,9 L; FEV1/FVC, 82% ± 4%; picco di flusso espiratorio (PEF), 10,5 ± 1,5 L/s) si sono offerti volontari per partecipare allo studio. Tutti i soggetti hanno mostrato una normale funzione polmonare in base alle equazioni di previsione (21). I soggetti sono stati testati alla stessa ora del giorno per ogni sessione e sono stati istruiti ad arrivare al laboratorio dopo essersi astenuti da caffeina, alcol e esercizio fisico intenso per le 24 ore precedenti. Tutti i soggetti hanno fornito il consenso informato scritto e tutte le procedure sperimentali sono state approvate dal comitato di revisione istituzionale dell’Università dell’Indiana.
Progetto sperimentale
I soggetti sono stati testati in 3 giorni, ciascuno separato da un minimo di 48 ore e un massimo di 1 settimana. Il giorno 1 includeva il test della funzionalità polmonare, la misurazione della pressione inspiratoria massima e la familiarizzazione con la prova a cronometro di 5 km, le procedure di test della funzionalità neuromuscolare e l’attività di respirazione resistiva. I giorni 2 e 3 sono stati eseguiti in ordine casuale e includevano una prova a cronometro di 5 km preceduta da un recupero da seduti (CON) o da un compito di respirazione resistiva inspiratoria (RMF). I giorni 2 e 3 includevano anche misurazioni della funzione neuromuscolare locomotoria (cioè quadricipite) prima e dopo l’esercizio. La misurazione della pressione inspiratoria massima, dopo l’attività di respirazione resistiva , è iniziata 1 minuto dopo l’esaurimento dell’attività. Sono stati eseguiti quattro sforzi massimi, ciascuno separato da 30s. I soggetti sono stati quindi trasferiti al cicloergometro (1,5 min) e hanno completato un riscaldamento di 3 minuti seguito da 1 minuto di recupero. Pertanto la prova a cronometro di 5 km è iniziata 8 minuti dopo il completamento del compito di respirazione resistiva. Le misurazioni della funzione del quadricipite sono iniziate 2 minuti dopo il completamento della cronometro di 5 km.
Test di funzionalità polmonare
La funzione polmonare è stata valutata utilizzando pneumotacografi inspiratori ed espiratori calibrati indipendentemente (serie 3813/4813; Hans Rudolph, Shawnee, KS) ed eseguiti in conformità con procedure standardizzate (22). Le misurazioni includevano FVC, FEV1 e PEF. I soggetti hanno acquisito familiarità con le prestazioni delle manovre FVC e hanno ricevuto feedback verbali. I soggetti hanno eseguito da tre a cinque manovre massime consistenti in un’ispirazione massima alla capacità polmonare totale e quindi un’espirazione massima al volume residuo. I più grandi FVC, FEV1 e PEF sono stati usati come rappresentazione della funzione polmonare del soggetto.
Massima pressione inspiratoria della bocca
La pressione respiratoria della bocca (Pm) è stata misurata attraverso una porta laterale nel boccaglio collegata a un trasduttore di pressione (Hector Engineering, Ellettsville, IN) che è stato calibrato utilizzando un manometro ad acqua. La valutazione della pressione orale massima è stata effettuata secondo procedure standardizzate (23). I soggetti hanno eseguito quattro sforzi inspiratori massimi iniziati dal volume residuo, con la media dei tre più alti definita come pressione inspiratoria massima (Pm, max). Gli sforzi inspiratori sono stati eseguiti contro un dispositivo personalizzato con un orifizio di 2 mm per prevenire la chiusura glottica. La pressione inspiratoria massima della bocca è stata misurata il giorno 1, prima e dopo 1 minuto l’attività di respirazione resistiva.
Cronometro
La potenza erogata durante le prove a cronometro di 5 km è stata misurata utilizzando un cicloergometro con frenatura elettromagnetica (Velotron Racermate, Seattle, WA). L’unico feedback fornito durante la cronometro è stata una visualizzazione continua della distanza percorsa. Le posizioni della sella e del manubrio sono state impostate in base alle preferenze del soggetto e registrate durante la prova di familiarizzazione per garantire un posizionamento coerente durante le prove successive.
Risposte all’esercizio
Le variabili metaboliche e ventilatorie sono state misurate continuamente durante l’esercizio utilizzando la calorimetria indiretta a circuito aperto con un carrello metabolico personalizzato. I soggetti respiravano attraverso un boccaglio (9060; Hans Rudolph) collegato a una valvola a due vie a bassa resistenza (2700; Hans Rudolph) dalla quale venivano raccolti i gas espirati in una camera di miscelazione da 5 litri. Campioni da questa camera di miscelazione, campionati a 300 mL/min, sono stati utilizzati per determinare le concentrazioni frazionarie di O2 e CO2 mediante analizzatori di gas O2 e CO2 separati (S-3A/CD-3A; Ametek Thermox Instruments, Pittsburgh, PA) . Gli analizzatori sono stati calibrati con concentrazioni di gas note entro l’intervallo fisiologico. Il flusso d’aria e le concentrazioni di gas sono stati digitalizzati e campionati a 50 Hz utilizzando un sistema di acquisizione dati (DASYLab; National Instruments, Norton, MA). Le manovre di capacità inspiratoria sono state eseguite negli ultimi 0,1 km di ogni segmento di 1 km (cioè 0,9, 1,9, ecc.). Il volume polmonare di fine espirazione (EELV) è stato calcolato sottraendo il volume della capacità inspiratoria da FVC ed espresso come percentuale di FVC. Il volume polmonare di fine inspirazione (EILV) è stato calcolato aggiungendo il volume corrente (VT) a EELV ed espresso come percentuale di FVC. L’RPE (scala Borg originale 6-20) e la dispnea (scala 0-10 modificata) (24) sono state ottenute al punto di tre quarti di ogni chilometro (cioè 0,75, 1,75, ecc.) durante la prova a tempo. Prima dell’inizio della cronometro, ai soggetti è stato letto un copione standard che spiegava la scala della dispnea: “questa è una scala che ti chiede di valutare la difficoltà del tuo respiro. Inizia dal numero zero dove il tuo respiro non ti causa difficoltà e progredisce fino al numero dieci dove la tua difficoltà respiratoria è massima. Al punto di tre quarti di ogni chilometro, ti verrà chiesto di valutare la difficoltà della tua respirazione indicando il numero corrispondente sulla carta laminata.”
Respirazione inspiratoria resistiva
Durante lo studio dell’RMF è stato svolta una fase di respirazione inspiratoria resistiva fino all’esaurimento del compito. Il compito di respirazione resistiva era simile nel design ad altri compiti noti per indurre RMF (3,25). I soggetti seduti in posizione eretta respiravano attraverso una valvola a due vie personalizzata collegata a un resistore di flusso personalizzato sul lato inspiratorio. Il target della pressione della bocca durante l’inspirazione era del 60%Pm,max. Durante la visita di familiarizzazione, i soggetti hanno praticato la respirazione attraverso l’apparato e il resistore di flusso è stato regolato per ciascun soggetto per garantire che il target di pressione potesse essere raggiunta ai parametri ventilatori richiesti. L’impostazione del resistore di flusso è stata registrata e la stessa impostazione è stata utilizzata durante la visita successiva (RMF). Ai soggetti è stato richiesto di mantenere una frequenza respiratoria specifica (15 respiri al minuto) e un ciclo di lavoro inspiratorio (TI/TTOT=0,67). I parametri ventilatori sono stati mantenuti attraverso il feedback fornito da un tracciamento visivo della pressione della bocca e dei metronomi con toni inspiratori ed espiratori distinti. Le pressioni della bocca durante ogni respiro non sono state mantenute in modo ondulato; pertanto, il picco di pressione della bocca durante ogni respiro (Pm) e la pressione media della bocca durante ogni respiro (P m) sono entrambi riportati. L’indice del tempo di tensione è stato calcolato per ogni minuto come prodotto del ciclo di lavoro inspiratorio e il rapporto tra la pressione orale media e la pressione orale massima (TTI = TI / TTOT × P m /Pm, max). Il fallimento, l’esaurimento del compito è stato definito come l’incapacità di generare il target pressorio della bocca per quattro respiri consecutivi. L’RMF è stato definito come un cambiamento significativo nella pressione massima della bocca dopo l’attività di respirazione resistiva rispetto alle misure a riposo. Durante il controllo, i partecipanti si sono seduti in silenzio per 20 minuti sulla stessa sedia utilizzata per l’attività di respirazione resistiva.
Affaticamento muscolare locomotore
L’affaticamento dell’apparato muscolare locomotore è stato quantificato come la riduzione percentuale della forza di contrazione del quadricipite potenziata (Qtw, pot) dal pre-esercizio al post-esercizio. I partecipanti erano seduti su una sella personalizzata con un angolo del tronco/coscia di 150° e un angolo dell’articolazione del ginocchio destro di 90°. Una fascia anelastica collegata ad una cella di carico calibrata (Model Z Tension Load Cell; Dillon, Fairmont, MN) è stata posizionata attorno alla caviglia destra appena sopra i malleoli. Uno stimolatore magnetico disponibile in commercio (Magstim 200-2; Jali Medical, Newton, MA) collegato a una bobina da 70 mm è stato utilizzato per stimolare il nervo femorale e tutte le forze evocate sono state campionate a 2000 Hz utilizzando un sistema di acquisizione dati (AcqKnowledge Software v 5.0; BIOPAC Systems, Inc., Goleta, CA). L’area di stimolazione è stata determinata dalla bobina di locazione all’interno del triangolo femorale che ha evocato la più grande forza di contrazione del quadricipite non potenziata (Qtw). Questa posizione è stata contrassegnata utilizzando inchiostro indelebile e sono state registrate misurazioni triangolate dai punti di riferimento anatomici per garantire il corretto posizionamento durante tutte le sessioni dei test. Per confermare che la stimolazione fosse sovramassimale, sono state ottenute due contrazioni, ciascuna separata da 30s, al 70%, 80%, 90%, 95% e 100% dell’output dello stimolatore. Prima e 2 minuti dopo l’esercizio sono state eseguite sei contrazioni volontarie massime (MVC) del quadricipite destro, separate da 30s, ciascuna per 3s. La forza di contrazione in risposta a una singola stimolazione sovramassimale (Qtw, pot) è stata misurata 2s dopo la MVC. L’ampiezza della forza di contrazione è stata calcolata come la differenza tra la forza di base e la forza di picco indotta dalla stimolazione sovramassimale ed è stata riportata come il valore medio delle ultime quattro contrazioni.
Uscita motoneuronale
L’attività mioelettrica del vasto laterale è stata registrata mediante l’EMG di superficie utilizzando elettrodi Ag/AgCl (EL501, BIOPAC Systems, Inc.). Gli elettrodi sono stati posizionati a circa 4 cm l’uno dall’altro sul ventre muscolare del vasto laterale parallelamente all’orientamento della fibra. La posizione degli elettrodi è stata contrassegnata utilizzando inchiostro indelebile e sono state registrate misurazioni triangolari dai punti di riferimento anatomici per garantire il corretto posizionamento durante tutte le sessioni dei test. Gli elettrodi sono stati utilizzati per misurare i potenziali di azione muscolare (onde M) evocati dalla stimolazione magnetica e dall’EMG durante l’esercizio per stimare la produzione motoneuronale (2,12). I segnali grezzi sono stati digitalizzati, campionati a 2000 Hz, filtrati passa-banda (20–500 Hz) e analizzati utilizzando un software disponibile in commercio (AcqKnowledge Software v 5.0; BIOPAC Systems, Inc.). L’ampiezza dell’onda M è stata calcolata come ampiezza da picco a picco ed è stata riportata come il valore medio delle ultime quattro onde M. Le contrazioni muscolari sono state identificate quando il segnale EMG è aumentato >2,5 DS al di sopra del rumore di base. La radice quadrata media EMG (RMS EMG) per ciascuna contrazione è stata calcolata utilizzando una costante di tempo di 100 ms ed è stata calcolata come media su ogni segmento di 1 km della prova a cronometro prima di essere normalizzata all’EMG RMS medio di 0,25 s più alto registrato durante il preesercizio MVC.
Analisi statistica
Le variabili dipendenti sono state valutate per la normalità ispezionando visivamente i grafici QQ-norm e utilizzando il test di Shapiro–Wilk e per la sfericità utilizzando il test di Mauchly, quando necessario. Se la sfericità fosse stata violata, è stato calcolato lo scostamento dalla sfericità (ε). Se ε <0,75, è stata applicata la correzione Greenhouse– Geisser, e se ε> 0,75, è stata applicata la correzione Huynh–Feldt. Sono stati utilizzati test t accoppiati per rilevare le differenze nella funzione neuromuscolare del quadricipite, nelle prestazioni ciclistiche e nella pressione inspiratoria massima della bocca. È stata utilizzata ANOVA a misure ripetute 2 × 5 (condizione in base alla distanza), per rilevare le differenze nelle variabili metaboliche, ventilatorie e percettive, nonché nella produzione di potenza e nell’EMG RMS, durante la prova a cronometro. A seguito di rapporti F significativi, sono stati effettuati confronti a coppie utilizzando il metodo Holm-Bonferroni. La significatività statistica è stata fissata a P <0,05.
Risultati
Respirazione inspiratoria resistiva
Tutti i soggetti hanno completato il protocollo di respirazione resistiva inspiratoria fino all’esaurimento dell’attività (26 ± 11 min). Le risposte fisiologiche all’attività respiratoria sono mostrate nella Tabella 1. Tutti i soggetti hanno mantenuto adeguatamente la frequenza respiratoria e i parametri del ciclo di lavoro inspiratorio per tutta la durata dell’attività. Tutti i soggetti hanno generato pressioni alla bocca uguali alle pressioni target fino al fallimento dell’attività. Come mostrato nella Figura 1, la pressione inspiratoria massima della bocca è stata ridotta in tutti i soggetti dopo l’attività di respirazione resistiva rispetto alla pressione di base, con una diminuzione media del gruppo di 28 ± 12 cm H2O (intervallo di confidenza al 95% (CI), 17-38 cm H2O; t7 = 6.412, P<0.001), che corrisponde a una variazione dal basale del 19% ± 9%.
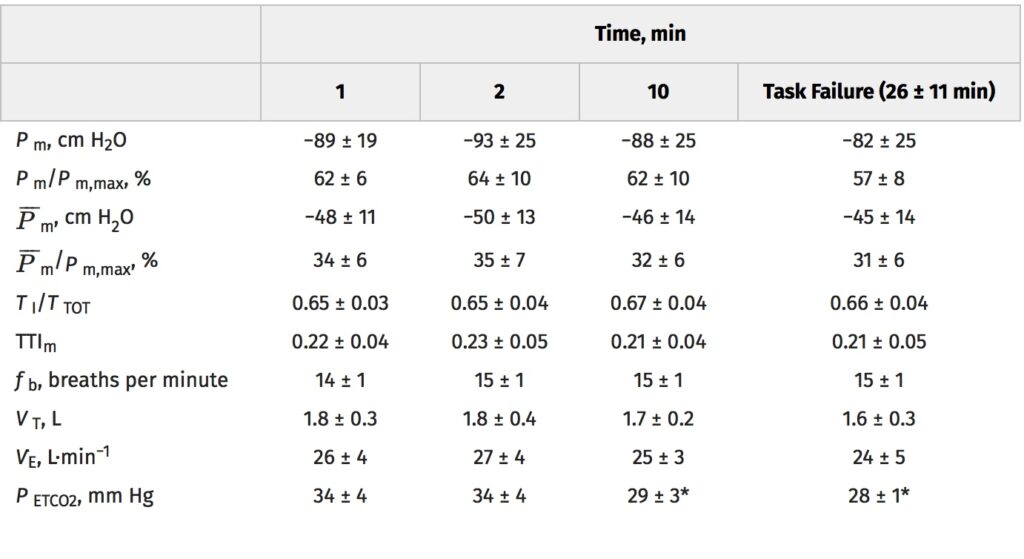
I dati sono presentati come medie ± SD. * Significativamente diverso dal primo minuto ( P <0,05). TTI m, indice del tempo di tensione della pressione della bocca; f b, frequenza respiratoria; P ETCO2 , fine pressione parziale di CO2.
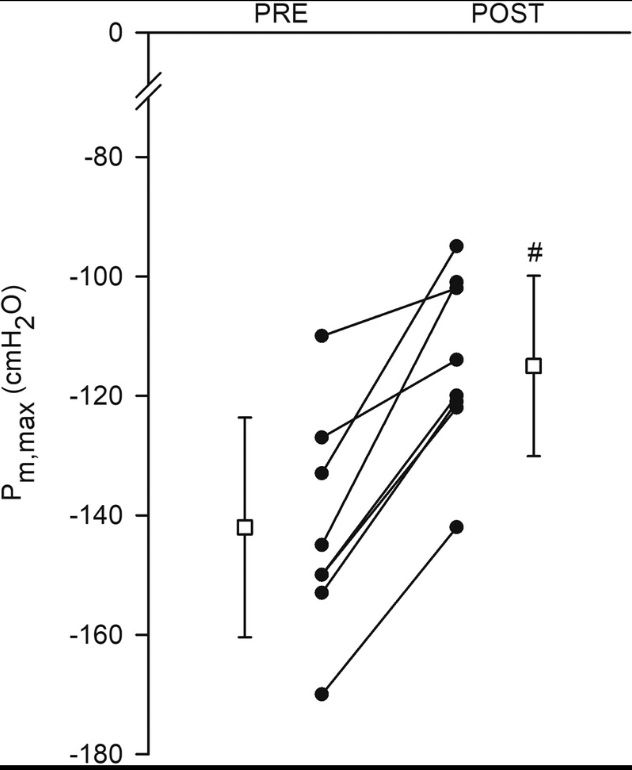
Figura 1: la massima pressione inspiratoria della bocca. Riduzioni nella pressione inspiratoria massimale della bocca (P m, max ) dopo l’obiettivo di resistenza inspiratoria. I cerchi pieni e le linee continue sono soggetti individuali. I quadrati aperti sono medie di gruppo ± SD ( n = 8). # Significativamente diverso da PRE( P <0,001).
Potenza motoneuronale, potenza erogata e prestazioni ciclistiche
L’EMG RMS e la potenza erogata durante la prova a cronometro sono mostrati nella Figura 2. L’analisi EMG RMS è stata condotta su sette soggetti, poiché ci sono state difficoltà tecniche durante una visita di raccolta dati per un soggetto. C’è stata un’interazione condizione-distanza per RMS EMG (F4,24 = 5.801, P = 0.002, η2p= 0,492). I confronti a coppie hanno rivelato una riduzione dell’EMG RMS (come% di MVC) in RMF rispetto a CON durante 1 km (differenza media, 8% ± 5%; 95% CI, 4% –13%; t6 = 4,569, P = 0,004 ) e 2 km (differenza media, 6% ± 4%; IC 95%, 2% –9%; t6 = 3,937, P = 0,008), ma nessuna differenza successivamente. C’è stata anche un’interazione condizione-distanza per la potenza in uscita (F4,28 = 6.428, P = 0.001, η2p= 0,479). I confronti a coppie hanno rivelato una riduzione della potenza in uscita in RMF rispetto a CON durante 1 km (differenza media, 62 ± 52 W; 95% CI, 18-105 W; t7 = 3,374, P = 0,012) e 2 km (differenza media, 21 ± 16 W; 95% CI, 7-35 W; t7 = 3,611, P = 0,009), ma successivamente nessuna differenza. Il tempo per completare la prova a cronometro di 5 km è stato aumentato (ovvero, prestazioni peggiori) in tutti i soggetti in RMF rispetto a CON (464 ± 24 vs 455 ± 26 s), con un aumento medio del gruppo di 9 ± 4 s (95% CI, 5-12 s; t7 = 5,625, P = 0,001; Fig.3). L’aumento del tempo per il completamento corrisponde a una variazione delle prestazioni dell’1,9% ± 0,9% (intervallo, 0,4% –3,8%).
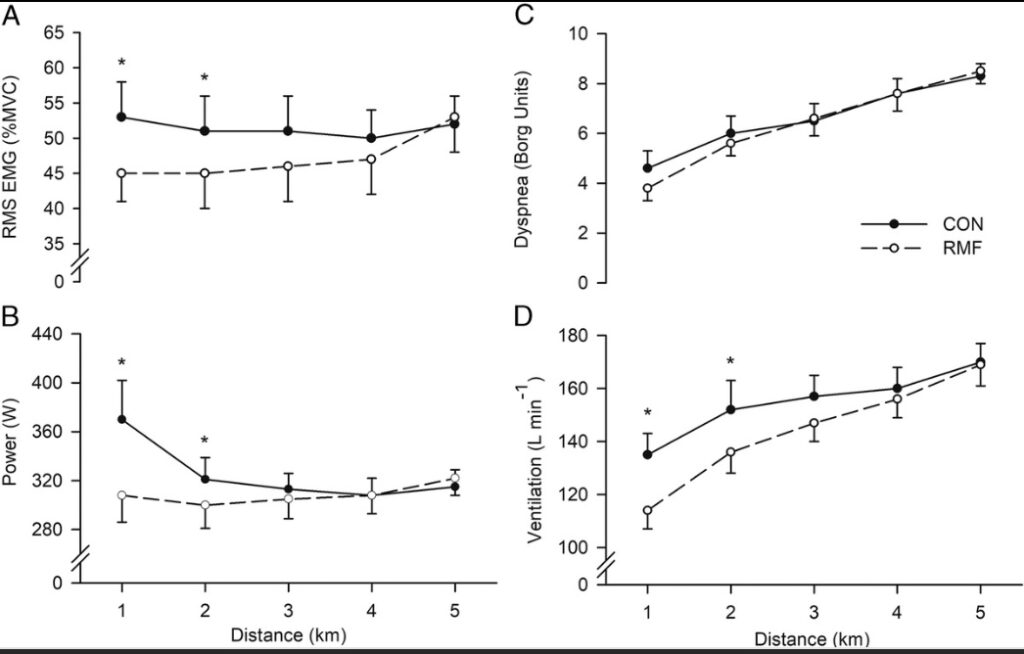
Figura 2: potenza motoneuronale, potenza erogata, valori di dispnea e ventilazione. RMS EMG del vasto laterale (A) e potenza (B) durante la cronometro di 5 km. RMS EMG è stato normalizzato a RMS EMG durante MVC pre-esercizio. I punti dati RMS EMG e potenza in uscita rappresentano il valore medio del gruppo nel segmento precedente di 1 km. Valutazioni di dispnea (C) e ventilazione (VE; D) durante la cronometro di 5 km. La dispnea è stata misurata entro i precedenti 0,25 km di ciascun punto dati e la V˙E è stata mediata sul segmento precedente di 0,5 km. I cerchi pieni e le linee continue sono CON. I cerchi aperti e le linee tratteggiate sono RMF. I dati sono presentati come medie ± SEM per chiarezza (n= 7 per RMS EMG en = 8 per altre variabili). * Significativamente diverso da CON (P <0,05).
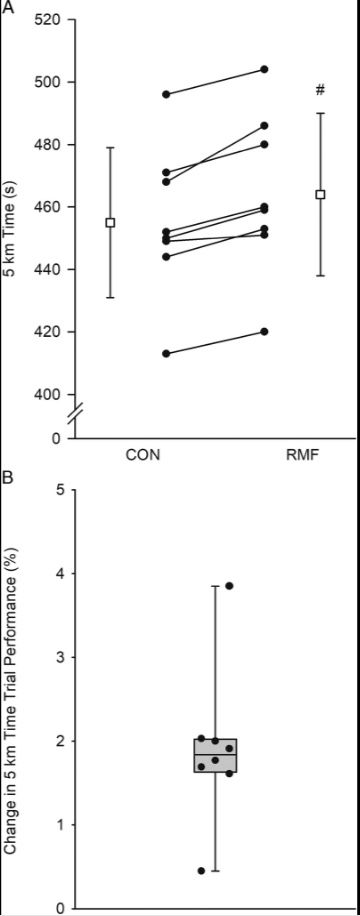
Figura 3: prestazione nella prova a tempo. A, Aumento del tempo per completare la prova a cronometro di 5 km (cioè, prestazioni peggiori) dopo l’attività di respirazione resistiva. I cerchi pieni e le linee continue sono soggetti individuali. I quadrati aperti sono medie di gruppo ± SD (n = 8). # Significativamente diverso da CON (P <0,001). B, Grafico a scatola della variazione percentuale delle prestazioni da CON a RMF. Una variazione percentuale più elevata indica un tempo più lungo per completare 5 km in bicicletta durante la condizione RMF (ovvero, prestazioni peggiori). I cerchi pieni sono soggetti individuali.
Risposte fisiologiche alla cronometro
Le risposte fisiologiche durante la prova a cronometro di 5 km sono mostrate nella Tabella 2. Più variabili avevano una condizione e un’interazione di distanza, con differenze a coppie tra CON e RMF solo durante 1 e 2 km. Non sono state rilevate differenze a coppie dai chilometri 3 a 5. È stata rilevata un’interazione condizione-distanza per la ventilazione minuto (V˙E; F4,28 = 5.691, P = 0.002, η2p= 0,448). I confronti a coppie hanno rivelato differenze tra CON e RMF durante 1 km (differenza media, 21 ± 13 L/min; 95% CI, 9-32 L/min; t7 = 4,569, P = 0,003) e 2 km (media differenza, 16 ± 12 L/min; 95% CI, 5-26 L/min; t7 = 3,595, P = 0,009). C’era anche un’interazione condizione-distanza per VT (F4,28= 7.741, P <0.001, η2p= 0,525). I confronti a coppie hanno rivelato differenze tra CON e RMF durante 1 km (differenza media, 0,4 ± 0,3 L; IC 95%, 0,2-0,7 L; t7 = 3,872, P = 0,006) e 2 km (differenza media, 0,3 ± 0,2 L; 95 % CI, 0,1-0,5 L; t7 = 3,981, P = 0,005). Per la frequenza respiratoria, non è stata rilevata alcuna interazione o effetto principale. Inoltre, non c’era interazione o effetto principale per i volumi polmonari operativi o il ciclo di lavoro inspiratorio (TI /TTOT).
Tabella 2 – Risposte fisiologiche durante la cronoscalata di 5 km.
C’è stata un’interazione condizione-distanza per l’assorbimento di ossigeno assoluto (VO2; F4,28 = 9,370, P <0,001, η2p= 0,572). I confronti a coppie hanno rivelato differenze tra CON e RMF durante 1 km (differenza media, 0,4 ± 0,3 L/min; IC 95%, 0,1-0,6 L/min; t7= 3,850, P= 0,006) e 2 km (media differenza, 0,2 ± 0,2 L/min; 95% CI, 0,1-0,4 L/min; t7= 3,404, P= 0,011). Inoltre c’è stata un’interazione condizione-distanza per la produzione assoluta di anidride carbonica (VCO2; F4,28= 19.173, P <0.001, η2p= 0,733). I confronti a coppie hanno rivelato differenze tra CON e RMF durante 1 km (differenza media, 1,0 ± 0,3 L/min; IC 95%, 0,8-1,3 L/min; t7= 9,376, P<0,001) e 2 km (media differenza, 0,7 ± 0,3 L/min; 95% CI, 0,4–1,0 L/min; t7= 5,723, P= 0,001). Le differenze osservate tra VO2 assoluto e VCO2 si sono riflesse in un’interazione RER condizione-distanza (F4,28= 22,997, P<0,001, η2p= 0,767), con confronti a coppie che rivelano differenze tra CON e RMF durante 1 km (differenza media, 0,15 ± 0,06; IC 95%, 0,10-0,20 L; t7= 7,673, P<0,001) e 2 km (differenza media, 0,11 ± 0,03; IC 95%, 0,08-0,14; t7= 8,804, P<0,001). Non sono state riscontrate interazioni o effetti principali per gli equivalenti ventilatori di O2 o CO2.
Percezione sensoriale
Non c’è stata interazione (F4,28= 2.456, P = 0,07, η2p= 0.260) o effetto principale della condizione (F4,28= 0.704, P = 0.429, η2p= 0,091) per le valutazioni della dispnea (Fig.2). Allo stesso modo, non c’era interazione (F4,28 = 2.579 P = 0,06, η2p= 0.269) o effetto principale della condizione (F4,28 = 3.066, P = 0.123, η2p= 0,305) per RPE.
Funzione muscolare del quadricipite
Un plateau vicino (aumento<5% di Qtw) è stato osservato in ciascun soggetto quando l’intensità della stimolazione è aumentata dal 90% al 100% e la media del gruppo Qtw al 100% non era diversa dal 90% (P= 0,15) o dal 95% (P = 0,26), indicando che l’intensità di stimolazione del 100% era sovramassimale.
Non ci sono state differenze nel Qtw pre-esercizio,pot tra CON (177 ± 39 N) e RMF (173 ± 36 N; differenza media, 4 ± 12 N; IC 95%, da -5 a 15 N; t7= 1.092, P= 0.31 ). Una grande riduzione di Qtw, pot è stata osservata sia in CON che in RMF dopo la cronometro di 5 km; tuttavia, la variazione percentuale da pre-esercizio a post-esercizio era maggiore in CON (28% ± 7%) rispetto a RMF (21% ± 6%; differenza media, 7% ± 7%; 95% CI, 1% -12%; t7= 3.006, P = 0,02; Fig.4).
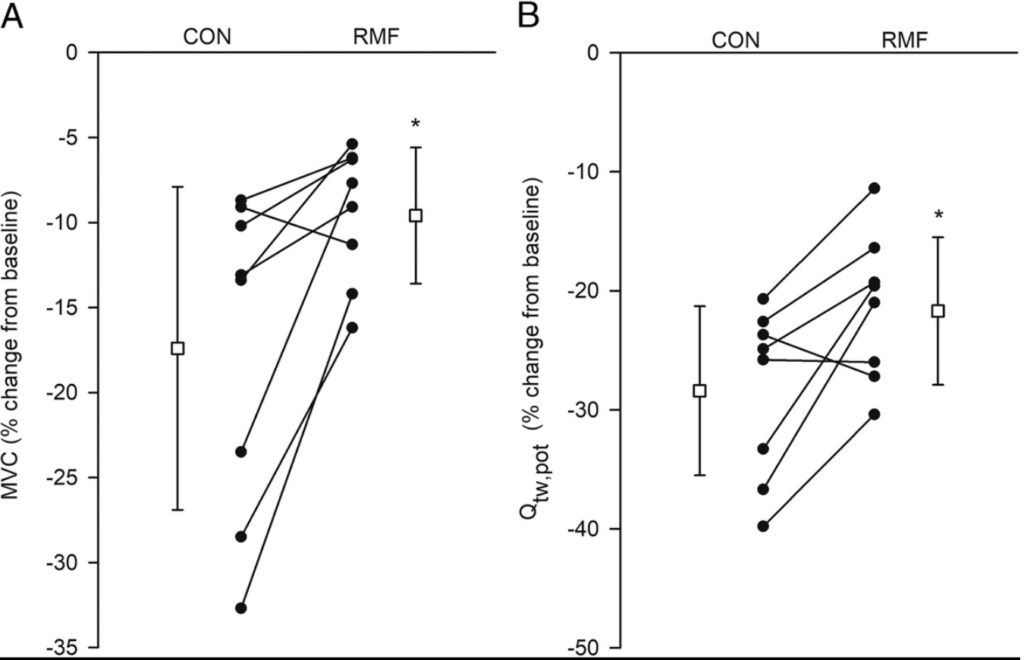
Figura 4: funzione neuromuscolare. Riduzioni della forza di contrazione del quadricipite potenziata magneticamente evocata (Q tw, pot; A) e della forza di picco generata durante la MVC (B) dopo la prova a cronometro di 5 km. I cerchi pieni e le linee continue sono soggetti individuali. I quadrati aperti sono medie di gruppo ± SD (n= 8). * Significativamente diverso da CON (P <0,05).
Non ci sono state differenze nell’MVC pre-esercizio tra CON (543 ± 112 N) e RMF (535 ± 113 N; differenza media, 8 ± 30 N; 95% CI, da -17 a 33 N; t7= 0,738, P= 0,49). La variazione percentuale da pre-esercizio a post-esercizio in MVC è stata maggiore in CON rispetto a RMF CON (17% ± 9%) rispetto a RMF (10% ± 4%; differenza media, 8% ± 7%; 95% CI, 2% -14 %; t7 = 3,101, P = 0,02; Fig.4).
Non sono state osservate differenze nell’ampiezza dell’onda M prima dell’esercizio dopo l’esercizio in CON (9,4 ± 0,3 vs 9,3 ± 0,3 mV, P = 0,29) o RMF (9,4 ± 0,3 vs 9,4 ± 0,3 mV, P = 0,29), suggerendo un’eccitabilità di membrana invariata.
Affidabilità
I coefficienti dei soggetti di variazione medi tra i giorni sono stati calcolati per le prestazioni ciclistiche utilizzando sessioni FAM e CON e per le Qtw, pot e MVC pre-esercizio utilizzando CON e RMF, secondo il metodo logaritmico. I coefficienti di variazione medi tra i giorni e all’interno dei soggetti erano del 2,1% per le prestazioni ciclistiche, del 5,1% per Qtw, pot e del 4,1% per MVC, che sono simili ai valori pubblicati dal nostro laboratorio e altri (26,27).
Discussione
I risultati principali del presente studio sono triplici. In primo luogo, la RMF preesistente ha causato alterazioni della percezione sensoriale della respirazione, tale che le valutazioni della dispnea durante la RMF fossero simili con CON, sebbene la ventilazione fosse inferiore in RMF rispetto a CON. In secondo luogo, delle diminuzioni concomitanti dell’output motoneuronale stimato (valutato con EMG di superficie) e dell’output di potenza hanno portato a un tempo più lento per completare la prova a tempo di 5 km in RMF, rispetto a CON. In terzo luogo il grado di affaticamento muscolare locomotorio indotto dall’esercizio è stato attenuato dopo la prova a cronometro con RMF preesistente.
Questi risultati suggeriscono che le valutazioni alterate della dispnea per una data ventilazione, secondaria a RMF, limitano la produzione motoneuronale e la potenza erogata durante l’esercizio. Inoltre la riduzione della produzione di energia osservata durante lo studio RMF ha probabilmente portato a una minore perturbazione metabolica all’interno dei muscoli locomotori, limitando così l’entità complessiva dell’affaticamento muscolare locomotore indotto dall’esercizio. Collettivamente questi risultati suggeriscono che il sistema respiratorio influenza il limite di tolleranza sensoriale ed è parte integrante della regolazione della prestazione fisica e dello sviluppo dell’affaticamento muscolare locomotore.
Percezione sensoriale
Gli autori hanno utilizzato un’attività di respirazione inspiratoria resistiva per indurre RMF prima di una cronometro in bicicletta e abbiamo osservato una sostanziale diminuzione della VE durante i primi 2 km della prova a cronometro RMF, tuttavia le valutazioni della dispnea sono state simili alla cronometro CON. Quindi sembra che RMF abbia causato alterazioni nella dispnea per un dato livello di ventilazione. L’alterazione della percezione dovuta alla RMF è coerente con altri studi (3,15,17,18) ed è probabilmente causata da un aumento del feedback afferente da muscoli respiratori affaticati e da cambiamenti nella scarica corollaria. La muscolatura respiratoria contiene neuroni del gruppo IV con terminazioni nervose libere che rispondono a livelli nocivi di vari metaboliti (ad esempio protoni e lattato) che si accumulano durante l’ischemia e l’affaticamento del diaframma (8,28-30). Queste afferenze si proiettano nelle lamine I e II del midollo spinale e forniscono un feedback alla corteccia somato-sensoriale (31). Le informazioni fornite dal feedback afferente vengono confrontate con la scarica corollaria feedforward e, se non corrispondenti, si traducono in cambiamenti nelle percezioni sensoriali della respirazione (14).
Durante l’esercizio di breve durata e ad alta intensità come quello intrapreso nello studio, un ampio RMF non si verifica durante le prime fasi dell’esercizio, ma si sviluppa invece verso la metà e l’ultima parte dell’esercizio poiché il lavoro cumulativo della respirazione diventa considerevole (32). Pertanto l’avvio della prova a tempo RMF con un grado sostanziale di RMF, probabilmente ha causato una mancata corrispondenza tra la scarica corollaria e il feedback afferente effettivo, portando a un aumento della dispnea per un dato livello di VE, almeno all’inizio della prova a tempo (1-2 km). Tuttavia poiché la prova a cronometro è continuata nella metà e nell’ultima parte della prova a cronometro RMF (3-5 km), durante la quale l’RMF si verifica normalmente nella nostra popolazione di soggetti, l’entità del disallineamento presumibilmente è diminuita, con conseguenti valutazioni simili di dispnea con ventilazione simile.
C’è stata anche una potenza di uscita significativamente inferiore durante i primi 2 km della cronometro RMF, sebbene l’RPE fosse simile a CON. Queste alterazioni della percezione dello sforzo sono simili ad altri studi che indagano gli effetti dell’affaticamento muscolare preesistente sulla prestazione fisica successiva (11,18,33). Due di questi studi hanno utilizzato esercizi a carico costante (11,33), mentre uno studio ha utilizzato esercizi di auto apprendimento (18) di natura paragonabile alla nostra prova a cronometro di 5 km, che ha permesso ai soggetti di variare liberamente la loro potenza. È interessante notare che quest’ultimo studio ha osservato cambiamenti nella percezione dello sforzo solo durante le prime fasi dell’esercizio, paragonabili ai risultati di questo studio. L’aumento dell’RPE per un dato livello di potenza all’inizio dell’esercizio può essere spiegato dall’integrazione delle informazioni sensoriali dei muscoli respiratori e locomotori prima della corteccia somatosensoriale (14). L’input delle sensazioni respiratorie esacerbate insieme a qualsiasi feedback afferente del muscolo locomotore in corso potrebbe causare un aumento dello sforzo percepito. Sono stati dimostrati risultati simili di input d’insieme da varie fonti che alterano la percezione sensoriale (11,12). Gli autori hanno interpretato questi risultati per suggerire che le informazioni sensoriali, sia che provengano dal sistema respiratorio o dal sistema locomotore, influenzano la percezione dello sforzo e contribuiscono a un limite di tolleranza sensoriale globale (13).
Potenza motoneuronale e potenza di uscita
Si è verificata una concomitante diminuzione dell’EMG RMS del quadricipite e della potenza erogata durante i primi 2 km della cronometro con RMF preesistente; tuttavia nessuna differenza si è verificata da allora in poi. Sebbene i cambiamenti nella produzione motoneuronale e la regolazione della potenza durante l’esercizio possano essere influenzati dalle afferenze del gruppo III/IV originate dai muscoli locomotori (2,6), due osservazioni suggeriscono che le afferenze locomotorie non sono state l’unico fattore determinante nelle alterazioni durante la prova a tempo con RMF preesistente. In primo luogo, la funzione neuromuscolare del quadricipite pre-esercizio è stata simile tra RMF e CON, ma il declino della funzione del quadricipite dopo l’esercizio è stato attenuato in RMF, rispetto a CON. Questa capacità di “riserva” del muscolo scheletrico suggerisce una fonte diversa delle afferenze locomotorie nella regolazione della produzione motoneuronale. In secondo luogo, le differenze nell’EMG RMS e nella potenza in uscita tra CON e RMF si sono verificate solo quando ci sono state anche alterazioni di dispnea per una data ventilazione. Man mano che le differenze nelle valutazioni della dispnea diminuivano, le differenze nell’EMG e nella potenza erogata tra CON e RMF diminuivano corrispondentemente. Di conseguenza, gli autori interpretano i cambiamenti nell’EMG e nella produzione di potenza in gran parte determinati dalle alterazioni della percezione sensoriale associate all’RMF, in contrasto con i soli cambiamenti nella funzione muscolare locomotoria.
Farmacologicamente l’attenuazione delle afferenze sensoriali nei muscoli locomotori aumenta la produzione motoneuronale e la produzione di potenza e può migliorare le prestazioni dell’esercizio (6,34,35). Il nostro studio è stato progettato, come altri hanno fatto (2,11), per fare l’opposto: affaticare un gruppo muscolare prima dell’esercizio per aumentare presumibilmente l’attività delle afferenze sensoriali. Pertanto, l’osservazione della diminuzione dell’EMG e della produzione di potenza in RMF fornisce un’ulteriore prova che le informazioni sensoriali relative all’affaticamento muscolare, indipendentemente dalla sua origine, contribuiscono alla regolazione dell’output motoneuronale. Inoltre, poiché abbiamo prefatigato i muscoli respiratori, al contrario dei muscoli locomotori, sembra che il sistema respiratorio contribuisca a un limite di tolleranza sensoriale ed è coinvolto in un ciclo di feedback negativo globale che regola la produzione motoneuronale e la prestazione fisica (1,13).
Prestazioni
Le diminuzioni osservate nella potenza erogata durante i primi 2 km di RMF hanno comportato un tempo maggiore di circa il 2% per completare i 5 km (cioè prestazioni peggiori). L’entità del cambiamento nelle prestazioni causato dalle differenze nella potenza erogata solo all’inizio dell’esercizio è paragonabile ad altri studi (36,37). Per quanto riguarda l’esercizio pre affaticante, l’entità del cambiamento osservato nelle prestazioni è in accordo con alcuni studi (2,18), ma è molto inferiore rispetto ad altri (11,17,19,33). Queste discrepanze possono essere dovute all’utilizzo di diverse modalità di esercizio. Gli studi che hanno riportato grandi riduzioni della tolleranza all’esercizio (14% -38%) (11,17,19,33) hanno utilizzato l’esercizio a carico costante, mentre gli studi che hanno riportato riduzioni più modeste delle prestazioni dal 2% al 6% (2,18) hanno utilizzato una modalità di esercizio di auto apprendimento in cui la potenza erogata era libera di variare, simile nel design allo studio in questione. In definitiva gli effetti differenziali della fatica pre esistente sul carico costante rispetto all’auto apprendimento richiedono un’indagine futura.
Affaticamento muscolare locomotore
Grandi riduzioni nella capacità di sviluppo della forza del quadricipite si sono verificate dopo entrambe le prove a cronometro; tuttavia la riduzione è stata maggiore in CON rispetto a RMF, suggerendo che i muscoli locomotori non hanno raggiunto la loro soglia critica in RMF e possedevano una riserva muscolare scheletrica. L’eziologia dell’affaticamento periferico è complessa, ma l’evidenza di studi sulle fibre muscolari isolate dimostra che l’accumulo di metaboliti (ad esempio, Pi, H+ e Mg2+) è uno dei meccanismi che contribuisce alla diminuzione della produzione di forza (38,39). In questo studio gli autori non hanno effettuato misurazioni dirette dell’accumulo di metaboliti durante l’esercizio e quindi è difficile stimare la sua influenza sull’affaticamento dei muscoli locomotori. Tuttavia la RER media durante i primi 2 km di CON era di circa 1,15, mentre la RER media durante i primi 2 km di RMF era di circa 1,02, indicando una maggiore produzione di anidride carbonica in CON, rispetto a RMF. Poiché anche la potenza erogata era inferiore durante l’RMF, rispetto al CON, gli autori ipotizzano che una minore perturbazione metabolica intramuscolare si sia verificata all’inizio della prova a cronometro RMF e si sia manifestata in un minore affaticamento muscolare locomotore dopo il completamento dell’esercizio.
Limitazioni e considerazioni tecniche
Gli autori hanno scelto di utilizzare i cambiamenti nella pressione inspiratoria massima della bocca per valutare l’RMF; tuttavia la misurazione accurata delle pressioni massimali della bocca può essere influenzata dalla familiarizzazione e dalla motivazione del soggetto. Per mitigare questi effetti, i soggetti sono stati completamente messi nelle conditio i di prendere familiarità con la procedura dei test della pressione massimale durante la sessione iniziale e durante la misurazione è stato fornito un forte incoraggiamento verbale insieme al feedback visivo della generazione della pressione. Gli autori hanno osservato una riduzione della pressione massimale della bocca in tutti i soggetti durante l’attività di respirazione resistiva, risultando in un robusto declino medio del gruppo nella generazione della pressione massima del 19% ± 9%. L’entità di questo cambiamento è in accordo con (40), che ha riportato un calo del 24% circa della pressione massimale inspiratoria insieme a una riduzione delle pressioni di contrazione transdiaframmatica. Inoltre il compito di respirazione resistiva utilizzato è stato scelto di proposito, poiché è stato dimostrato che induce l’affaticamento del diaframma (3,25). Il progetto dello studio non ha consentito la misurazione dell’andamento nel tempo del recupero dalla fatica; tuttavia un simile compito di respirazione resistiva che ha indotto l’affaticamento del diaframma ha causato una diminuzione della capacità di generazione di pressione del muscolo fino a 30 minuti (25). Poiché l’attività ciclistica in questo studio è iniziata circa 8 minuti dopo la cessazione dell’attività respiratoria, è improbabile che si sia verificato un sostanziale recupero dalla fatica. Nel loro insieme, gli autori sono fiduciosi che i cambiamenti osservati nella pressione inspiratoria massimale della bocca si siano verificati a causa di un grado sostanziale di RMF e questa fatica dei muscoli respiratori si è verificata all’inizio dell’attività ciclistica.
Anche l’esclusione delle donne da questo esame iniziale dell’RMF sulle prestazioni nelle prove a cronometro merita un commento. Alcune prove suggeriscono che esistono differenze tra uomini e donne nell’affaticabilità del diaframma durante la respirazione resistiva inspiratoria (33) e anche durante l’esercizio ad alta intensità (33,41). Inoltre sulla base di prove recenti, sembra che uomini e donne abbiano percezioni diverse dello sforzo (p. Es., Dispnea, RPE) durante l’esercizio con affaticamento del diaframma preesistente (33) così come differenze nei modelli di reclutamento dei muscoli accessori durante l’esercizio ad alta intensità (42 ). Basato su queste possibili variabili confondenti, gli autori hanno scelto di testare solo uomini per questo esame iniziale dell’RMF sulle prestazioni delle prove a cronometro. Pertanto generalizzare i risultati a tutte le popolazioni è limitato. Studi futuri dovrebbero indagare i meccanismi alla base delle differenze basate sul sesso menzionate in precedenza, nonché le potenziali differenze basate sul sesso nel limite di tolleranza sensoriale.
La stima dell’output motoneuronale dall’EMG di superficie al muscolo bersaglio ha limitazioni intrinseche che sono state riviste da esperti altrove (43) e non è una misura esatta della spinta neurale ai muscoli locomotori. Gli autori hanno tentato di ridurre al minimo alcuni dei limiti registrando attentamente la posizione degli elettrodi nella sessione iniziale utilizzando misurazioni triangolate da punti di riferimento anatomici e contrassegnando la posizione con inchiostro indelebile. Inoltre hanno anche normalizzato l’attività EMG RMS durante l’esercizio ciclistico al massimo EMG RMS osservato durante il MVC pre-esercizio. Le differenze osservate nell’attività EMG RMS tra CON e RMF si sono verificate durante le stesse parti della cronometro come le differenze osservate nella produzione di potenza tra CON e RMF. Inoltre verso la fine della prova a tempo in ciascuna condizione, i soggetti hanno aumentato sia la potenza erogata che l’EMG RMS. Pertanto gli autori hanno interpretato questi cambiamenti nel senso che i ciclisti stavano autoregolando la loro potenza in uscita come parte di un ciclo di feedback globale.
Conclusioni
In conclusione l’RMF preesistente altera la percezione sensoriale durante il successivo esercizio globale, portando a una diminuzione della potenza. La riduzione della produzione di energia durante l’esercizio globale probabilmente diminuisce la perturbazione metabolica e attenua l’affaticamento dei muscoli locomotori. Questi risultati indicano che il sistema respiratorio influenza il limite di tolleranza sensoriale ed è parte integrante di un ciclo di feedback globale che regola la prestazione fisica e lo sviluppo dell’affaticamento muscolare locomotore.
Riferimenti
Tratto da: Fulton T.J.; Baranauskas M.N.; Paris H.L.; Koceja D.M.; Mickelborough T.D..; Chapman R.F. Respiratory Muscle Fatigue Alters Cycling Performance and Locomotor Muscle Fatigue, Medicine & Science in Sports & Exercise: November 2020 – Volume 52 – Issue 11 – pp. 2380-2389
- Gandevia SC. Spinal and supraspinal factors in human muscle fatigue. Physiol Rev. 2001;81(4):1725–89.
- 2. Amann M, Dempsey JA. Locomotor muscle fatigue modifies central motor drive in healthy humans and imposes a limitation to exercise performance. J Physiol. 2008;586(1):161–73.
- Welch JF, Archiza B, Guenette JA, West CR, Sheel AW. Sex differences in diaphragmatic fatigue: the cardiovascular response to inspiratory resistance. J Physiol. 2018;596(17):4017–32.
- Hureau TJ, Olivier N, Millet GY, Meste O, Blain GM. Exercise performance is regulated during repeated sprints to limit the development of peripheral fatigue beyond a critical threshold. Exp Physiol. 2014;99(7):951–63.
- Rossman MJ, Garten RS, Venturelli M, Amann M, Richardson RS. The role of active muscle mass in determining the magnitude of peripheral fatigue during dynamic exercise. Am J Physiol Regul Integr Comp Physiol. 2014;306(12):R934–40.
- Blain GM, Mangum TS, Sidhu SK, et al. Group III/IV muscle afferents limit the intramuscular metabolic perturbation during whole body exercise in humans. J Physiol. 2016;594(18):5303–15.
- Garland S, Kaufman M. Role of muscle afferents in the inhibition of motoneurons during fatigue. Adv Exp Med Bio. 1995;384:271–8.
- Light AR, Hughen RW, Zhang J, Rainier J, Liu Z, Lee J. Dorsal root ganglion neurons innervating skeletal muscle respond to physiological combinations of protons, ATP, and lactate mediated by ASIC, P2X, and TRPV1. J Neurophysiol. 2008;100(3):1184–201.
- Hogan MC, Richardson RS, Haseler LJ. Human muscle performance and PCr hydrolysis with varied inspired oxygen fractions: a31P-MRS study. J Appl Physiol. 1999;86(4):1367–73.
- Burnley M, Vanhatalo A, Fulford J, Jones AM. Similar metabolic perturbations during all-out and constant force exhaustive exercise in humans: a 31P magnetic resonance spectroscopy study. Exp Physiol. 2010;95(7):798–807.
- Johnson MA, Sharpe GR, Williams NC, Hannah R. Locomotor muscle fatigue is not critically regulated after prior upper body exercise. J Appl Physiol. 2015;119(7):840–50.
- Amann M, Venturelli M, Ives SJ, et al. Peripheral fatigue limits endurance exercise via a sensory feedback-mediated reduction in spinal motoneuronal output. J Appl Physiol. 2013;115(3):355–64.
- Hureau TJ, Romer LM, Amann M. The ‘sensory tolerance limit’: a hypothetical construct determining exercise performance?Eur J Sport Sci. 2018;18(1):13–24.
- Sheel AW, Foster GE, Romer LM. Exercise and its impact on dyspnea. Curr Opin Pharmacol. 2011;11(3):195–203.
- Martin B, Heintzelman M, Chen H. Exercise performance after ventilatory work. J Appl Physiol. 1982;52(6):1581–5.
- Dodd S, Powers S, Thompson D, Landry G, Lawler J. Exercise performance following intense, short-term ventilatory work. Int J Sports Med. 1989;10(1):48–52.
- Mador MJ, Acevedo FA. Effect of respiratory muscle fatigue on subsequent exercise performance. J Appl Physiol. 1991;70(5):2059–65.
- Verges S, Sager Y, Erni C, Spengler C. Expiratory muscle fatigue impairs exercise performance. Eur J Appl Physiol. 2007;101(2):225–32.
- Wüthrich TU, Notter DA, Spengler CM. Effect of inspiratory muscle fatigue on exercise performance taking into account the fatigue-induced excess respiratory drive. Exp Physiol. 2013;98(12):1705–17.
- Romer LM, Lovering AT, Haverkamp HC, Pegelow DF, Dempsey JA. Effect of inspiratory muscle work on peripheral fatigue of locomotor muscles in healthy humans. J Physiol. 2006;571(2):425–39.
- Hankinson JL, Odencrantz JR, Fedan KB. Spirometric reference values from a sample of the general US population. Am J Respir Crit Care Med. 1999;159(1):179–87.
- Miller MR, Hankinson J, Brusasco V, et al. Standardisation of spirometry. Eur Respir J. 2005;26(2):319–38.
- American Thoracic Society/European Respiratory Society. ATS/ERS Statement on respiratory muscle testing. Am J Respir Crit Care Med. 2002;166(4):518.
- Borg GA. Psychophysical bases of perceived exertion. Med Sci Sports Exerc. 1982;14(5):377–81.
- Peters CM, Welch JF, Dominelli PB, et al. Influence of inspiratory resistive loading on expiratory muscle fatigue in healthy humans. Exp Physiol. 2017;102(9):1221–33.
- Paris HL, Fulton TJ, Chapman RF, Fly AD, Koceja DM, Mickleborough TD. Effect of carbohydrate ingestion on central fatigue during prolonged running exercise in moderate hypoxia. J Appl Physiol. 2018;126(1):141–51.
- Romer LM, Haverkamp HC, Lovering AT, Pegelow DF, Dempsey JA. Effect of exercise-induced arterial hypoxemia on quadriceps muscle fatigue in healthy humans. Am J Physiol Regul Integr Comp Physiol. 2006;290(2):R365–75.
- Graham R, Jammes Y, Delpierre S, Grimaud C, Roussos C. The effects of ischemia, lactic acid and hypertonic sodium chloride on phrenic afferent discharge during spontaneous diaphragmatic contraction. Neurosci Lett. 1986;67(3):257–62.
- Hill JM. Discharge of group IV phrenic afferent fibers increases during diaphragmatic fatigue. Brain Res. 2000;856(1–2):240–4.
- Pollak KA, Swenson JD, Vanhaitsma TA, et al. Exogenously applied muscle metabolites synergistically evoke sensations of muscle fatigue and pain in human subjects. Exp Physiol. 2014;99(2):368–80.
- Jankowski MP, Rau KK, Ekmann KM, Anderson CE, Koerber HR. Comprehensive phenotyping of group III and IV muscle afferents in mouse. J Neurophysiol. 2013;109(9):2374–81.
- Archiza B, Welch JF, Geary CM, Allen GP, Borghi-Silva A, Sheel AW. Temporal characteristics of exercise-induced diaphragmatic fatigue. J Appl Physiol. 2017;124(4):906–14.
- Welch JF, Archiza B, Guenette JA, West CR, Sheel AW. Effect of diaphragm fatigue on subsequent exercise tolerance in healthy men and women. J Appl Physiol. 2018;125(12):1987–96.
- Broxterman RM, Hureau TJ, Layec G, et al. Influence of group III/IV muscle afferents on small muscle mass exercise performance: a bioenergetics perspective. J Physiol. 2018;596(12):2301–14.
- Hureau TJ, Weavil JC, Thurston TS, et al. Pharmacological attenuation of group III/IV muscle afferents improves endurance performance when oxygen delivery to locomotor muscles is preserved. J Appl Physiol. 2019;127(5):1257–66.
- Aisbett B, Le Rossignol P, McConell GK, Abbiss CR, Snow R. Effects of starting strategy on 5-min cycling time-trial performance. J Sports Sci. 2009;27(11):1201–9.
- Felippe LC, Ferreira GA, Learsi SK, Boari D, Bertuzzi R, Lima-Silva AE. Caffeine increases both total work performed above critical power and peripheral fatigue during a 4-km cycling time trial. J Appl Physiol. 2018;124(6):1491–501.
- Westerblad H, Allen D. Myoplasmic free Mg2+ concentration during repetitive stimulation of single fibres from mouse skeletal muscle. J Physiol. 1992;453(1):413–34.
- Sundberg CW, Hunter SK, Trappe SW, Smith CS, Fitts RH. Effects of elevated H+ and Pi on the contractile mechanics of skeletal muscle fibres from young and old men: implications for muscle fatigue in humans. J Physiol. 2018;596(17):3993–4015.
- Sliwinski P, Yan S, Gauthier AP, Macklem PT. Influence of global inspiratory muscle fatigue on breathing during exercise. J Appl Physiol. 1996;80:1270–8.
- Guenette JA, Romer LM, Querido JS, et al. Sex differences in exercise-induced diaphragmatic fatigue in endurance-trained athletes. J Appl Physiol. 2010;109(1):35–46.
- Mitchell RA, Schaeffer MR, Ramsook AH, Wilkie SS, Guenette JA. Sex differences in respiratory muscle activation patterns during high-intensity exercise in healthy humans. Respir Physiol Neurobiol. 2018;247:57–60.
- Farina D, Holobar A, Merletti R, Enoka RM. Decoding the neural drive to muscles from the surface electromyogram. Clin Neurophysiol. 2010;121(10):1616–23.
