Physical Activity Reduces the Risk of Recurrence and Mortality in Cancer Patients
Brown, Justin C.; Gilmore, L. Anne – Exercise and Sport Sciences Reviews: Aprile 2020 – Volume 48 – Edizione 2° – p. 67 -73
Introduzione
Pur non avendo evidenza di metastasi a distanza alla diagnosi, una percentuale sostanziale di pazienti con cancro svilupperà recidive di malattia metastatica entro 5 anni dalla resezione del tumore (1). La recidiva di malattia metastatica (ad es.sistemica) segna il passaggio dalla malattia localizzata, potenzialmente curabile, a quella diffusa, spesso incurabile, che rappresenta il 90% dei decessi per cancro (2). Esiste una necessità clinica di identificare ulteriori strategie terapeutiche che possono ridurre il rischio di recidiva sistemica e mortalità in questa popolazione.
La prescrizione dell’attività fisica è una potenziale strategia terapeutica per ridurre il rischio di recidiva sistemica e mortalità in questa popolazione. L’attività fisica è definita come qualsiasi movimento corporeo prodotto dal muscolo scheletrico che richiede dispendio di energia (3). Studi prospettici di coorte osservazionali riportano che l’attività fisica è associata a un minor rischio di recidiva sistemica e mortalità nei pazienti con diagnosi di diversi tipi di cancro. Ad esempio, tra 2987 donne con carcinoma mammario in stadio I-III, la partecipazione all’attività fisica dopo la diagnosi è stata associata a una riduzione del 24% nella recidiva della malattia e una riduzione del 45% nella mortalità (4). Tra 832 uomini e donne con carcinoma del colon in stadio III, la pratica di attività fisica è stata associata a una riduzione del 40% nella recidiva della malattia e una riduzione del 63% nella mortalità (5). È importante sottolineare che queste associazioni erano indipendenti da vari fattori prognostici o confondenti demografici, clinici, patologici e legati al trattamento.
Nonostante la forza e la coerenza di questi dati osservativi, i meccanismi biologici attraverso i quali l’attività fisica (o l’esercizio fisico) riduce il rischio di recidiva sistemica e mortalità non sono ancora noti. Le ipotesi prevalenti sostengono che i benefici dell’attività fisica sono attribuibili agli adattamenti sistemici che si verificano nel microambiente ospite, come cambiamenti favorevoli nei fattori di crescita metabolica, infiammazione e funzione immunitaria (6). Questi cambiamenti creano un microambiente tumorale ospite insufficiente per l’inizio e la progressione metastatica. Tuttavia anche le forze meccaniche sono implicate in questo (7). Studi microfluidici dimostrano che lo stress da taglio fluido, simile a quello del flusso sanguigno vascolare, influenza direttamente la vitalità cellulare, altera le caratteristiche intracellulari, ritarda i tassi di crescita e attenua il potenziale metastatico delle cellule tumorali circolanti (8, 9). Recentemente, uno “studio di prova del concetto” ha dimostrato che l’attività fisica ha ridotto le cellule tumorali circolanti nei pazienti con asportato carcinoma del colon in stadio I-III (10). Collettivamente questi risultati offrono la logica secondo cui anche l’attività fisica può avere un effetto sulle cellule tumorali attraverso un meccanismo fisico diretto, come lo stress da taglio nel sistema vascolare.
In questa recensione proponiamo un’ipotesi che unifica la ricerca storica con le scoperte contemporanee. Esploriamo l’ipotesi che l’attività fisica riduca il rischio di recidiva e mortalità sistemica nei pazienti oncologici attraverso due processi sinergici:
- effetti indiretti (sistemici) nel microambiente del tumore ospite;
- effetti diretti (fisici) sulle cellule tumorali.
La maggior parte delle ricerche condotte in quest’area ha incluso pazienti con carcinoma mammario e del colon-retto; tuttavia descriviamo come questa ipotesi possa essere applicabile ad altri tumori solidi. Chiarire i meccanismi attraverso i quali l’attività fisica riduce il rischio di recidiva sistemica e mortalità è una delle domande senza risposta più provocatorie in oncologia. Questa recensione fornisce una logica che amplierà il nostro pensiero, promuoverà un dialogo costruttivo e offrirà una premessa stimolante su cui progettare la ricerca futura per chiarire i meccanismi biologici che collegano l’attività fisica con i risultati del cancro.
L’attività fisica è associata alla ricomparsa del cancro a alla mortalità
Un decesso per cancro su 10 è attribuito a un’attività fisica insufficiente (11). Quasi due dozzine di studi prospettici di coorte osservazionali hanno riportato l’associazione inversa tra la partecipazione all’attività fisica dopo la diagnosi di recidiva del cancro e la mortalità in pazienti con tumori allo stadio iniziale della mammella, del colon-retto e della prostata. È importante riconoscere che nonostante l’adeguamento statistico per variabili prognostiche o confondenti, un’interpretazione conservativa di questi dati è essenziale perché non si può presumere la causalità. Questi dati sono stati integrati in revisioni sistematiche e meta-analisi (12,13). In breve un’analisi di otto studi che hanno incluso 15.298 pazienti con carcinoma mammario, del colon-retto e della prostata ha dimostrato che volumi più elevati di attività fisica post-diagnosi diagnosticata sono stati associati con una riduzione del 45% del rischio di recidiva del cancro (hazard ratio (HR), 0,65; intervallo di confidenza al 95% (CI), 0,56 – 0,75) (13). Inoltre tra 21 studi che hanno coinvolto 38.560 pazienti, maggiori volumi auto-segnalati di attività fisica post diagnosi sono stati associati con una riduzione del 37% della mortalità per cancro (HR, 0,63; IC al 95%, 0,54-0,73) (13). I pazienti che traggono i maggiori benefici clinici dall’attività fisica sono quegli individui che erano fisicamente inattivi prima della diagnosi e aumentavano il loro volume di attività fisica dopo la diagnosi (12). In un campione rappresentativo nazionale di pazienti affetti da cancro, l’8% si è impegnato in ≥ 150 min/settimane di attività fisica misurata oggettivamente ad intensità da moderata a vigorosa (14). Di conseguenza esiste una potenziale opportunità di utilizzare la promozione dell’attività fisica come strategia terapeutica per migliorare i risultati dopo una diagnosi di cancro.
La cascata metastatica e le implicazioni porgnostiche
La diffusione delle cellule tumorali da un tumore primario a organi distanti è un processo complesso con eventi sequenziali e simultanei che si verificano durante la cascata metastatica. I passaggi chiave includono lo spargimento di cellule tumorali dal tumore primario, l’intravasazione nella circolazione, la migrazione verso organi distanti, lo stravaso nel tessuto circostante e l’avvio della crescita e della proliferazione (15). L’intravasazione può verificarsi sotto forma di singole cellule tumorali o ammassi tumorali che sono legati ad altre cellule come leucociti, piastrine e proteine. La vascolarizzazione è un ambiente inospitale perché le cellule tumorali diventano vulnerabili alla sorveglianza naturale delle cellule killer e alla distruzione a causa dello stress fisico della circolazione. Durante la circolazione, le cellule tumorali acquisiscono protezione immunitaria attraverso il rivestimento piastrinico e il clustering di neutrofili (16). Le cellule tumorali devono possedere plasticità per adattarsi a un nuovo microambiente e possono impedire alla divisione cellulare di persistere in uno stato di quiescenza fino a quando non vengono acquisite nuove mutazioni o le condizioni ambientali consentono il riavvio della proliferazione (17). Sono state descritti passaggi meccanicistici dettagliati di questi processi complessi (18).
Come precursori di metastasi rilevate clinicamente e potenzialmente letali, la rilevazione e la quantificazione delle cellule tumorali circolanti fornisce una visione meccanicistica unica per la ricerca traslazionale. Esistono più di tre dozzine di piattaforme per il rilevamento di cellule tumorali (19). La presenza di cellule tumorali circolanti è associata a recidiva sistemica e mortalità in una varietà di tipi di tumori solidi. Ad esempio, tra 735 uomini e donne con carcinoma del colon-retto di stadio II e III, la presenza di ≥1 cellula tumorale circolante era associata a un triplo rischio di recidiva (HR, 3,02; IC al 95%, 1,83 – 5,00) e quasi quattro volte superiore rischio di mortalità (HR, 3,84; IC al 95%: 2,41 – 6,22) rispetto agli individui senza una cellula tumorale circolante rilevabile (20). In una meta-analisi di 19 studi su 2993 donne con carcinoma mammario in stadio I-III, la presenza di ≥1 cellula tumorale circolante era associata a un rischio di recidiva quasi triplicato (HR, 2,86; IC al 95%, 2,19 – 3,75) e la mortalità (HR, 2,78; IC al 95%, 2,22 – 3,48) rispetto alle donne senza una cellula tumorale circolante rilevabile e i tempi del prelievo di sangue (ad es. prima, durante o dopo la terapia del cancro) non hanno influenzato sostanzialmente questi risultati ( 21). Le cellule tumorali circolanti spesso diminuiscono dopo l’inizio del trattamento e aumentano con la progressione della malattia e la resistenza al trattamento (22). Pertanto le cellule tumorali circolanti sono collocate in modo univoco come potenziale biomarcatore farmacodinamico per studi clinici (23). L’analisi delle cellule tumorali circolanti nel sangue periferico – una biopsia liquida – può offrire spunti unici sui meccanismi biologici attraverso i quali l’attività fisica riduce il rischio di recidiva sistemica e mortalità nei pazienti oncologici.
I meccanismi biologici che collegano l’attività fisica alla reiterazione e alla morte del cancro
- Panoramica
I meccanismi biologici attraverso i quali l’attività fisica può ridurre il rischio di recidiva sistemica e mortalità nei pazienti oncologici sono una complessa interazione di molteplici percorsi teorizzati (Fig. 1). Questa interazione può essere dovuta, in parte, agli effetti polifarmacologici o pleiotropici dell’attività fisica. Fino ad oggi la maggior parte degli studi si è concentrata su meccanismi correlati al microambiente tumorale ospite, inclusi fattori di crescita metabolica, infiammazione e immunità, che sono implicati nella crescita e proliferazione delle cellule tumorali. Molti di questi meccanismi possono essere mediati dalla composizione corporea, come adiposità e muscoli, che possono anche secernere i propri fattori, adipokine e myokines (citochine), rispettivamente. Qui descriviamo brevemente i dati che supportano l’importanza di questi meccanismi in relazione all’attività fisica e alla ricorrenza sistematica e alla mortalità.
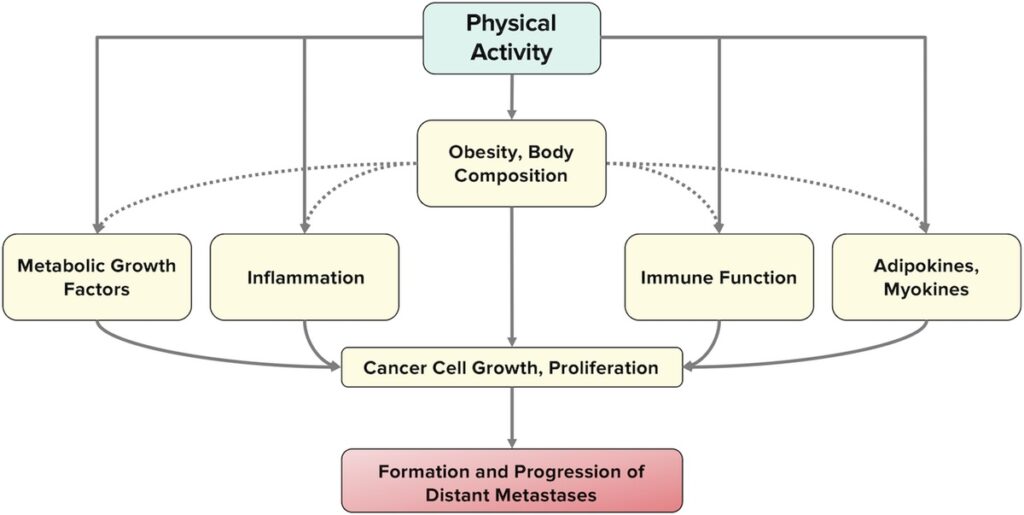
Figura 1: Meccanismi ipotizzati alla base dell’associazione tra attività fisica e sviluppo di recidiva sistemica e mortalità. Gli effetti dell’attività fisica possono essere mediati, in parte, dalla composizione corporea.
- Fattori di crescita metabolica
Uno dei meccanismi più comunemente studiati include i fattori di crescita metabolica e la segnalazione dell’insulina. Le cellule tumorali spesso sovra esprimono il recettore dell’insulina, il che potrebbe spiegare perché le cellule tumorali hanno aumentato la sensibilità all’iperinsulinemia attraverso l’attivazione della via PI3K-Akt-mTOR (24). In una studio di coorte di 512 donne senza diabete noto con carcinoma mammario in stadio I-III, concentrazioni più elevate di insulina plasmatica a digiuno, indipendentemente dal tumore e da fattori correlati al trattamento, erano associate a un elevato doppio rischio di recidiva a distanza (HR, 2,0; IC al 95% , 1,2 – 3,3) e triplice rischio di mortalità (HR, 3,1; IC 95%, 1,7 – 5,7), rispetto alle concentrazioni più basse di insulina plasmatica a digiuno (25). Tra 373 uomini e donne con carcinoma del colon-retto in stadio I-III, concentrazioni più elevate di peptide C, una misura della secrezione d’insulina, erano indipendentemente associate ad un aumentato rischio di morte (HR, 2,11; IC al 95%, 1,06 – 4,21) rispetto alle concentrazioni più basse di C-peptide (26). Una meta-analisi di sette studi randomizzati e controllati che ha incluso 369 donne con carcinoma mammario in stadio I-III ha dimostrato che l’attività fisica riduceva le concentrazioni di insulina plasmatica a digiuno (-24,0 pmol/L; IC al 95%, – 41,5, – 6,6) e questi effetti possono essere mediati dalla perdita di peso (27). Un’analoga entità della riduzione delle concentrazioni plasmatiche di insulina a digiuno è stata segnalata in uno studio randomizzato controllato su uomini e donne con carcinoma del colon in stadio I – III (−28,0 ± 31,2 pmol/L) e i cambiamenti nelle concentrazioni d’insulina sono stati correlati con i cambiamenti nell’area del tessuto adiposo viscerale (r= 0,37) (28).
Infiammazione
L’infiammazione sistemica cronica di basso grado è considerata un promotore della progressione del tumore, derivante da macrofagi associati al tumore che rilasciano citochine e attivano vari percorsi tra cui PI3K-Akt-mTOR, JAK-STAT e NF-kB per promuovere la proliferazione e la sopravvivenza delle cellule (29) ). Le concentrazioni circolanti di proteine della fase acuta dell’infiammazione sistemica, come le proteine C-reattive, sono associate ad un aumentato rischio di recidiva sistemica e mortalità in molti tumori solidi (30). Tra le 2919 donne con carcinoma mammario in stadio I-IIIA, concentrazioni più elevate di proteina C reattiva sono state associate ad aumenti linearmente proporzionali della recidiva del carcinoma mammario (HR, 1,13; IC 95%, 1,03 – 1,24) e mortalità (HR, 1,19; 95% CI, 1,05 – 1,34) (31). La valutazione degli effetti antinfiammatori dell’attività fisica è complicata dall’osservazione che un singola seduta di attività spesso aumenta acutamente l’infiammazione, mentre l’attività fisica costante (ad es. a lungo termine) provoca una diminuzione dell’infiammazione (32). Altre misure di infiammazione, come GlycA, un biomarker dell’acetili glicoproteina legata all’azoto circolante sono stati collegati al rischio di cancro e alla prognosi (33) e possono offrire una visione meccanicistica complementare a questi complessi percorsi e alle loro interazioni con l’esercizio. Un’analisi aggregata di tre studi randomizzati ha dimostrato che l’attività di rinforzo muscolare costante ha ridotto la proteina C reattiva in 215 donne con carcinoma mammario in stadio I-III rispetto al controllo (34), e uno studio randomizzato in corso sta valutando gli effetti anti-infiammatori di 12 settimane di attività aerobica di intensità moderata in pazienti con carcinoma del colon in stadio III (NCT03975491).
Funzione immunitaria
Negli adulti sani, l’attività aerobica costante di moderata intensità è associata a una varietà di cambiamenti favorevoli al sistema immunitario e adattativo e una sola seduta di esercizio aerobico di moderata intensità aumenta la mobilizzazione delle cellule killer naturali, delle cellule T e delle cellule B (35). Il ruolo dell’immunità innata e adattativa nel metabolismo del cancro è stato tenuto in considerazione a lungo e l’integrazione della prima generazione di inibitori del checkpoint immunitario ha rapidamente trasformato il panorama delle cure oncologiche (36). Vi sono prove crescenti che la composizione periferica e tumorale delle cellule immunitarie è associata sia al rischio di cancro, che alla prognosi (37). In uno studio di coorte di 3625 uomini e donne, una maggiore attività citotossica dei linfociti del sangue periferico è stata associata in modo indipendente con un rischio inferiore del 36% di sviluppare carcinoma invasivo durante 11 anni di follow-up (HR, 0,64; IC al 95%, 0,44-0,94) ( 38). È importante notare che il test di citotossicità in questo studio è stato completato contro una linea cellulare da neoplasie ematologiche (leucemia mieloide cronica), mentre la maggior parte delle neoplasie osservate (n= 154) erano tumori solidi (ad esempio gastrointestinali e polmonari). Uno studio randomizzato su 53 pazienti con carcinoma mammario post-menopausale ha dimostrato che l’attività aerobica di moderata intensità ha aumentato l’attività citotossica delle cellule killer naturali (6,8%; IC 95%, 0,4 – 13,3) (39); tuttavia altri parametri immunitari sono rimasti invariati in questo studio e altri studi clinici non si sono osservati cambiamenti nell’attività litica (fase del ciclo riproduttivo di virus e batteri) dopo l’esercizio, il che evidenzia la complessità dello studio della funzione immunitaria e sottolinea la necessità di ulteriori studi.
Composizione corporea
Varie misurazioni di composizione corporea sono state associate a recidiva e mortalità nei pazienti tra 3262 uomini e donne con carcinoma del colon-retto in stadio I-III, la combinazione di adiposità totale in eccesso e bassa massa muscolare era associata a un rischio di mortalità superiore del 40% rispetto agli individui senza adiposità in eccesso e massa muscolare sufficiente (HR, 1,40; 95 % CI, 1,03 – 1,90) (40). Risultati simili sono stati riportati nel carcinoma mammario in stadio II-III (41). Studi randomizzati e controllati hanno dimostrato che l’attività aerobica di intensità moderata riduce l’adiposità viscerale (intra-addominale) tra i pazienti con carcinoma del colon, in modo tale che ogni aumento di 60 minuti/settimana di attività aerobica riduca l’adiposità viscerale di 2,7 cm2 (IC al 95%: – 5.1, −0.1) (42) e l’attività di rinforzo muscolare previene la perdita di massa magra appendicolare tra le donne con carcinoma mammario in stadio I-III (0,07 kg/m2; IC al 95%, 0,01-0,14) (43). Non è chiaro se la composizione corporea funge da intermediario ai percorsi biologici metabolici, infiammatori e immunitari precedentemente descritti o ha un effetto diretto sulle cellule tumorali attraverso fattori secreti, come adipokine e myokine.
Risposta delle cellule tumorali allo stress da taglio fluido
I modelli preclinici sperimentali di stress da taglio sulle cellule tumorali circolanti dimostrano che le forze meccaniche influenzano la vitalità delle cellule tumorali. Ad esempio in una linea cellulare di adenocarcinoma del colon-retto (COLO 225) utilizzando un viscosimetro a cono e piastra per fornire una velocità di taglio uniforme e controllata, aumentando l’apoptosi (44), le cellule tumorali sensibilizzate dallo stress da taglio; a una durata fissa di 120 minuti, le sollecitazioni di taglio di 0,4, 1,0 e 2,0 din/cm2 hanno indotto l’apoptosi delle cellule tumorali, mentre le sollecitazioni di taglio di 0,05 e 0,1 din/cm2 non hanno influito sulla vitalità cellulare (44). A una sollecitazione di taglio fissa di 2,0 din/cm2, la durata dell’esposizione a sollecitazione di taglio di 60, 90 e 120 minuti ha aumentato l’apoptosi cellulare, mentre la durata di 10 e 30 minuti non ha influito sulla vitalità cellulare (44). Queste osservazioni iniziali sono state replicate nelle linee cellulari di carcinoma mammario, ovarico e polmonare; tuttavia, le cellule leucemiche erano più resistenti alle forze di taglio (45). Sono allo studio i processi specifici attraverso i quali lo stress da taglio induce l’apoptosi delle cellule tumorali; tuttavia le ipotesi suggeriscono che i recettori meccano-sensibili sulla superficie delle cellule tumorali possono indurre l’arresto del ciclo cellulare (8).
L’attività aerobica induce aumenti sostanziali dello stress da taglio vascolare (5,0 – 6,5 din/ cm2) (46) e studi sull’uomo, generando ipotesi, hanno iniziato a documentare la potenziale importanza delle cellule tumorali circolanti nel campo del metabolismo del cancro. Uno studio randomizzato controllato ha esplorato l’ipotesi che l’attività fisica possa ridurre le cellule tumorali circolanti in 23 pazienti con carcinoma del colon in stadio I-III asportato, che hanno terminato il trattamento del cancro 9,0 ± 6,1 mesi prima dell’arruolamento nello studio (10). I pazienti sono stati randomizzati in uno dei tre gruppi: controllo della cura abituale, 150 min/sett. di attività aerobica (dosaggio basso) e 300 min/sett. di attività aerobica (dosaggio alto) per 6 mesi. Nell’arco di 6 mesi sono state osservate riduzioni statisticamente significative nelle cellule tumorali circolanti nei gruppi a dosaggio basso (−1,34 ± 0,34 cellule/ml) e a dosaggio alto (−1,18 ± 0,40 cellule/ml), mentre non si è verificato un cambiamento statisticamente significativo nel gruppo di controllo (−0,59 ± 0,56 cellule/ml). Ulteriori analisi hanno dimostrato che le riduzioni dell’indice di massa corporea, dell’insulina plasmatica a digiuno e delle concentrazioni di molecole di adesione intercellulare – 1 (ICAM-1) possono mediare parzialmente l’associazione tra esercizio e conta delle cellule tumorali circolanti. L’ICAM-1 è una molecola della cellula endoteliale che si esprime su cellule immunitarie e cellule tumorali e che insieme al suo ligando LFA-1 (CD11a/CD18) è anche implicata nell’adesione e nello stravaso cellulare (47). È in corso uno studio di conferma per replicare la nuova osservazione secondo cui l’esercizio fisico riduce le cellule tumorali circolanti (NCT03975491) in pazienti con carcinoma del colon in stadio III.
La prossima frontiera di un’ipotesi unificata
Sulla base dei dati precedentemente descritti, ipotizziamo che l’attività fisica riduca il rischio di recidiva sistemica e mortalità nei pazienti oncologici attraverso due processi sinergici:
- Effetti indiretti (sistemici) correlati al microambiente tumorale ospite;
- Effetti diretti (fisico) effetti sulle cellule tumorali (Fig. 2).
Per le cellule tumorali che sono entrate nella circolazione, l’attività fisica può ridurre la proporzione di cellule tumorali disponibili da estrapolare in organi distanti. Ciò può verificarsi inducendo l’apoptosi attraverso lo stress da taglio indotto dall’esercizio che viene rilevato dai meccano-recettori sulla superficie delle cellule tumorali. Per le cellule tumorali che non hanno ceduto allo stress da taglio o che si sono già estrapolate in organi distanti, l’attività fisica può ridurre l’abbondanza di fattori di crescita (ad es. insulina) e aumentare l’immuno-sorveglianza nel microambiente del tumore ospite per prevenire o rallentare la formazione o la progressione del focolaio metastatico. Se l’attività fisica influisce favorevolmente su entrambe le fasi principali della metastasi – traslocazione fisica di una cellula cancerosa e colonizzazione distante – tale terapia può essere pronta a offrire benefici clinici duraturi ai pazienti.
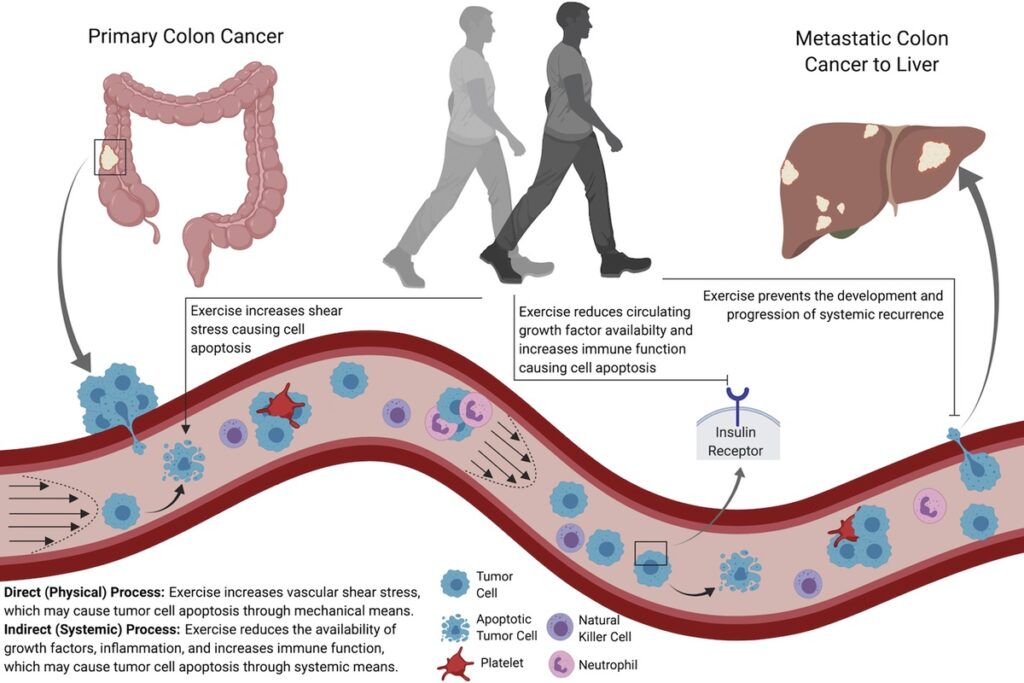
Figura 2: Ipotesi che l’attività fisica riduca il rischio di recidiva e mortalità nei pazienti oncologici attraverso due processi sinergici: 1) effetti indiretti (sistemici) correlati al microambiente del tumore ospite; e 2) effetti diretti (fisici) sulle cellule tumorali.
Sono necessarie ulteriori ricerche per valutare empiricamente questa ipotesi. Innanzitutto, identificare la fonte delle cellule tumorali nei pazienti che hanno completato il trattamento per il carcinoma in stadio iniziale è un passo critico per rafforzare le prove a supporto di questa ipotesi. Nei pazienti con carcinoma in fase iniziale, non è noto se le cellule tumorali siano state liberate dal tumore primario prima della resezione chirurgica o provengano da focolai micro-metastatici distanti non ancora identificati clinicamente. In secondo luogo, il campo si è concentrato principalmente sui benefici cronici (ad es. a lungo termine o longitudinali) dell’attività fisica; scarsa è la ricerca che ha esaminato gli effetti acuti dell’attività fisica sui meccanismi che si presume siano correlati alla ricomparsa sistemica e alla mortalità. Inoltre pochi studi randomizzati hanno valutato sistematicamente l’efficacia delle diverse modalità di esercizio, volumi e frequenze comparata agli endpoint unici per i pazienti oncologici. Gli studi sull’esercizio fisico in questa popolazione dovrebbero basarsi sulle solide basi della scienza dell’esercizio in popolazioni sane, non semplicemente cercare di replicare ciò che è noto e considerato generalizzabile in condizioni di salute. In terzo luogo, dati gli effetti polifarmacologici o pleiotropici dell’attività fisica, gli approcci alla biologia dei sistemi possono accelerare il tasso di scoperta in quest’area. In quarto luogo, esaminando gli effetti comparativi della riduzione delle cellule tumorali attraverso forze meccaniche praticando attività fisica rispetto esclusivamente all’alterazione del microambiente tumorale, ad esempio utilizzando la perdita di peso, fornirebbe prove per valutare questa ipotesi. L’esercizio fisico e la perdita di peso possono avere effetti sinergici per ridurre le cellule tumorali attraverso gli effetti combinati delle forze meccaniche derivanti dall’esercizio fisico e i cambiamenti nel microambiente del tumore ospite derivanti dalla perdita di peso. Un’ipotesi simile può essere testata con terapie farmacologiche, come l’aspirina per ridurre l’aggregazione piastrinica e tumorale per ridurre l’efficienza meccanica dello stravaso, o la metformina per ridurre l’insulina plasmatica a digiuno per limitare la disponibilità del fattore di crescita. Quando le cellule tumorali circolanti subiscono l’apoptosi, viene rilasciato il DNA tumorale circolante (48) e la comprensione degli effetti dell’esercizio fisico sul DNA tumorale circolante può offrire ulteriori informazioni meccanicistiche.
La Food and Drug Administration (FDA) ha recentemente approvato il pembrolizumab, un inibitore programmato del ligando di morte cellulare-1, per il trattamento di pazienti adulti e pediatrici con tumori solidi non asportabili o metastatici, con instabilità dei microsatelliti o con difetti di riparazione non corrispondenti, indipendentemente dal sito del tumore o dall’istologia (49). Questa è la prima volta che la FDA approva una terapia anticancro agnostica su tessuto e sito. Con una continua comprensione della biologia del tumore, il campo della scienza dell’esercizio può presto essere pronto a condurre studi che mirano a percorsi di segnalazione specifici che sono implicati in più siti tumorali (ad esempio, studi clinici sull’esercizio agnostico di tessuto e sito). Se possibile nella scienza dell’esercizio, un tale paradigma trasformativo accelererebbe la nostra comprensione dei benefici specifici sul cancro dell’esercizio fisico, in un modo conveniente ed economico.
Prove randomizzate con endpoints di malattie cliniche
Nonostante i dati osservativi e l’entusiasmo degli scienziati circa la traslazione per chiarire i potenziali meccanismi biologici, la causalità della relazione tra attività fisica, recidiva sistemica e mortalità nei pazienti oncologici non è stata ancora dimostrata. Numerosi studi randomizzati multicentrici in corso determineranno se l’attività fisica migliora gli esiti clinici in pazienti con diversi tipi e stadi di cancro. Lo studio “Colon Health and Life-Long Exercise Change” (CHALLENGE) esaminerà gli effetti di un programma di esercizi aerobici di 36 mesi sulla libera sopravvivenza dalla malattia in 962 pazienti con carcinoma del colon in stadio II o stadio III ad alto rischio (NCT00819208). L’intenso esercizio per la sopravvivenza tra gli uomini con carcinoma della prostata metastatico resistente alla castrazione (INTERVAL-GAP4) esaminerà gli effetti in 24 mesi di esercizi di forza e le combinazioni di allenamento ad intervallo ad alta intensità e programmi d’esercizio aerobico continuo di moderata intensità, sulla sopravvivenza globale in 866 uomini con carcinoma prostatico in stadio IV (NCT0273033). Oltre a offrire un test definitivo di causalità dell’attività fisica sull’esito clinico, tutti questi studi includono solidi studi correlativi che forniranno ulteriori informazioni meccanicistiche ai processi biologici che spiegano gli effetti benefici dell’attività fisica. È fondamentale che questi studi di fase III mirino a validare endpoints di biomarcatori surrogati e quantifichino le differenze clinicamente importanti per i biomarcatori precedentemente descritti.
Limitazioni
Vi sono potenziali limiti a questa ipotesi. La considerazione principale riguarda i tempi dello sviluppo della recidiva sistemica nel cancro. È probabile che per alcuni pazienti le cellule tumorali siano già state travasate in organi distanti al momento della diagnosi del carcinoma in fase iniziale, ma non siano ancora rilevabili clinicamente. Anche se si presume spesso che singole metastasi vengano seminate esattamente una volta da una singola cellula cancerosa o da un piccolo gruppo di cellule cancerose, studi recenti hanno dimostrato che in condizioni tipiche, 10 – 150 cellule tumorali seminano ciascuna una metastasi (50). Pertanto anche se diverse cellule tumorali hanno seminato un sito metastatico al momento della diagnosi, impegnarsi in attività fisica dopo la diagnosi iniziale può prevenire, ritardare o interrompere la continua semina di cellule tumorali nel sito metastatico distante. Inoltre anche tra i pazienti con carcinoma metastatico evidente (ad es. lesioni polmonari e epatiche misurabili), il declino longitudinale del numero di cellule tumorali circolanti è associato a una prognosi migliorata rispetto ai pazienti con un numero stabile, persistentemente elevato o con un aumento longitudinale di cellule tumorali circolanti (22).
Conclusioni
Questa recensione delinea l’evidenza dell’ipotesi che i meccanismi biologici attraverso i quali l’attività fisica previene la ricomparsa del cancro sistemico e modula i tassi di mortalità si verifica attraverso due processi sinergici: 1) effetti indiretti (sistemici) correlati al microambiente tumorale ospite e 2) diretto (fisico) effetti sulle cellule tumorali. Si prevede che questa recensione 1) fornisca una logica per espandere il nostro modo di pensare, 2) promuova il dialogo costruttivo e transdisciplinare e 3) offra una premessa stimolante su cui progettare la ricerca futura per chiarire i meccanismi biologici che collegano l’attività fisica ai risultati del cancro, verso l’obiettivo di sviluppare strategie terapeutiche che hanno dimostrato di ridurre la morbilità e la mortalità associate al cancro.
Riferimenti bibliografici
1. Pantel K, Alix-Panabieres C. Liquid biopsy and minimal residual disease — latest advances and implications for cure. Nat. Rev. Clin. Oncol. 2019; 16(7):409–24.
2. Chaffer CL, Weinberg RA. A perspective on cancer cell metastasis. Science. 2011; 331(6024):1559–64.
3. Caspersen CJ, Powell KE, Christenson GM. Physical activity, exercise, and physical fitness: definitions and distinctions for health-related research. Public Health Rep. 1985; 100(2):126–31.
4. Holmes MD, Chen WY, Feskanich D, Kroenke CH, Colditz GA. Physical activity and survival after breast cancer diagnosis. JAMA. 2005; 293(20):2479–86.
5. Meyerhardt JA, Heseltine D, Niedzwiecki D, et al. Impact of physical activity on cancer recurrence and survival in patients with stage III colon cancer: findings from CALGB 89803. J. Clin. Oncol. 2006; 24(22):3535–41.
6. Ballard-Barbash R, Friedenreich CM, Courneya KS, Siddiqi SM, McTiernan A, Alfano CM. Physical activity, biomarkers, and disease outcomes in cancer survivors: a systematic review. J. Natl. Cancer Inst. 2012; 104(11):815–40.
7. Mierke CT. The fundamental role of mechanical properties in the progression of cancer disease and inflammation. Rep. Prog. Phys. 2014; 77(7):076602.
8. Mitchell MJ, King MR. Computational and experimental models of cancer cell response to fluid shear stress. Front. Oncol. 2013; 3:44.
9. Jain RK, Martin JD, Stylianopoulos T. The role of mechanical forces in tumor growth and therapy. Annu. Rev. Biomed. Eng. 2014; 16:321–46.
10. Brown JC, Rhim AD, Manning SL, et al. Effects of exercise on circulating tumor cells among patients with resected stage I–III colon cancer. PLoS One. 2018; 13(10):e0204875.
11. van Dam RM, Li T, Spiegelman D, Franco OH, Hu FB. Combined impact of lifestyle factors on mortality: prospective cohort study in US women. BMJ. 2008; 337:a1440.
12. Schmid D, Leitzmann MF. Association between physical activity and mortality among breast cancer and colorectal cancer survivors: a systematic review and meta-analysis. Ann. Oncol. 2014; 25(7):1293–311.
13. Friedenreich CM, Neilson HK, Farris MS, Courneya KS. Physical activity and cancer outcomes: a precision medicine approach. Clin. Cancer Res. 2016; 22(19):4766–75.
14. Thraen-Borowski KM, Gennuso KP, Cadmus-Bertram L. Accelerometer-derived physical activity and sedentary time by cancer type in the United States. PLoS One. 2017; 12(8):e0182554.
15. Chambers AF, Groom AC, MacDonald IC. Dissemination and growth of cancer cells in metastatic sites. Nat. Rev. Cancer. 2002; 2(8):563–72.
16. Szczerba BM, Castro-Giner F, Vetter M, et al. Neutrophils escort circulating tumour cells to enable cell cycle progression. Nature. 2019; 566(7745):553–7.
17. Joosse SA, Gorges TM, Pantel K. Biology, detection, and clinical implications of circulating tumor cells. EMBO Mol. Med. 2015; 7(1):1–11.
18. Lambert AW, Pattabiraman DR, Weinberg RA. Emerging biological principles of metastasis. Cell. 2017; 168(4):670–91.
19. Ferreira MM, Ramani VC, Jeffrey SS. Circulating tumor cell technologies. Mol. Oncol. 2016; 10(3):374–94.
20. Iinuma H, Watanabe T, Mimori K, et al. Clinical significance of circulating tumor cells, including cancer stem-like cells, in peripheral blood for recurrence and prognosis in patients with Dukes’ stage B and C colorectal cancer. J. Clin. Oncol. 2011; 29(12):1547–55.
21. Zhang L, Riethdorf S, Wu G, et al. Meta-analysis of the prognostic value of circulating tumor cells in breast cancer. Clin. Cancer Res. 2012; 18(20):5701–10.
22. Hayes DF, Cristofanilli M, Budd GT, et al. Circulating tumor cells at each follow-up time point during therapy of metastatic breast cancer patients predict progression-free and overall survival. Clin. Cancer Res. 2006; 12(14 Pt 1):4218–24.
23. Devriese LA, Voest EE, Beijnen JH, Schellens JH. Circulating tumor cells as pharmacodynamic biomarker in early clinical oncological trials. Cancer Treat. Rev. 2011; 37(8):579–89.
24. Belfiore A, Malaguarnera R. Insulin receptor and cancer. Endocr. Relat. Cancer. 2011; 18(4):R125–47.
25. Goodwin PJ, Ennis M, Pritchard KI, et al. Fasting insulin and outcome in early-stage breast cancer: results of a prospective cohort study. J. Clin. Oncol. 2002; 20(1):42–51.
26. Wolpin BM, Meyerhardt JA, Chan AT, et al. Insulin, the insulin-like growth factor axis, and mortality in patients with nonmetastatic colorectal cancer. J. Clin. Oncol. 2009; 27(2):176–85.
27. Kang DW, Lee J, Suh SH, Ligibel J, Courneya KS, Jeon JY. Effects of exercise on insulin, IGF axis, adipocytokines, and inflammatory markers in breast cancer survivors: a systematic review and meta-analysis. Cancer Epidemiol. Biomarkers Prev. 2017; 26(3):355–65.
28. Brown JC, Rickels MR, Troxel AB, et al. Dose-response effects of exercise on insulin among colon cancer survivors. Endocr. Relat. Cancer. 2018; 25(1):11–9.
29. Coussens LM, Werb Z. Inflammation and cancer. Nature. 2002; 420(6917):860–7.
30. Shrotriya S, Walsh D, Bennani-Baiti N, Thomas S, Lorton C. C-reactive protein is an important biomarker for prognosis tumor recurrence and treatment response in adult solid tumors: a systematic review. PLoS One. 2015; 10(12): e0143080.
31. Villasenor A, Flatt SW, Marinac C, Natarajan L, Pierce JP, Patterson RE. Postdiagnosis C-reactive protein and breast cancer survivorship: findings from the WHEL study. Cancer Epidemiol. Biomarkers Prev. 2014; 23(1):189–99.
32. Ploeger HE, Takken T, de Greef MH, Timmons BW. The effects of acute and chronic exercise on inflammatory markers in children and adults with a chronic inflammatory disease: a systematic review. Exerc. Immunol. Rev. 2009; 15:6–41.
33. Chandler PD, Akinkuolie AO, Tobias DK, et al. Association of N-linked glycoprotein acetyls and colorectal cancer incidence and mortality. PLoS One. 2016; 11(11):e0165615.
34. Winters-Stone KM, Wood LJ, Stoyles S, Dieckmann NF. The effects of resistance exercise on biomarkers of breast cancer prognosis: a pooled analysis of three randomized trials. Cancer Epidemiol. Biomarkers Prev. 2018; 27(2):146–53.
35. Duggal NA, Niemiro G, Harridge SDR, Simpson RJ, Lord JM. Can physical activity ameliorate immunosenescence and thereby reduce age-related multi-morbidity? Nat. Rev. Immunol. 2019; 19(9):563–72.
36. Ribas A, Wolchok JD. Cancer immunotherapy using checkpoint blockade. Science. 2018; 359(6382):1350–5.
37. Idorn M, Hojman P. Exercise-dependent regulation of NK cells in cancer protection. Trends Mol. Med. 2016; 22(7):565–77.
38. Imai K, Matsuyama S, Miyake S, Suga K, Nakachi K. Natural cytotoxic activity of peripheral-blood lymphocytes and cancer incidence: an 11-year follow-up study of a general population. Lancet. 2000; 356(9244):1795–9.
39. Fairey AS, Courneya KS, Field CJ, Bell GJ, Jones LW, Mackey JR. Randomized controlled trial of exercise and blood immune function in postmenopausal breast cancer survivors. J. Appl. Physiol. (1985). 2005; 98(4):1534–40.
40. Caan BJ, Meyerhardt JA, Kroenke CH, et al. Explaining the obesity paradox: the association between body composition and colorectal cancer survival (C-SCANS study). Cancer Epidemiol. Biomarkers Prev. 2017; 26(7):1008–15.
41. Caan BJ, Cespedes Feliciano EM, Prado CM, et al. Association of muscle and adiposity measured by computed tomography with survival in patients with nonmetastatic breast cancer. JAMA Oncol. 2018; 4(6):798–804.
42. Brown JC, Zemel BS, Troxel AB, et al. Dose-response effects of aerobic exercise on body composition among colon cancer survivors: a randomised controlled trial. Br. J. Cancer. 2017; 117(11):1614–20.
43. Brown JC, Schmitz KH. Weight lifting and appendicular skeletal muscle mass among breast cancer survivors: a randomized controlled trial. Breast Cancer Res. Treat. 2015; 151(2):385–92.
44. Mitchell MJ, King MR. Fluid shear stress sensitizes cancer cells to receptor-mediated apoptosis via trimeric death receptors. New J. Phys. 2013; 15(1):015008.
45. Regmi S, Fu A, Luo KQ. High shear stresses under exercise condition destroy circulating tumor cells in a microfluidic system. Sci. Rep. 2017; 7:39975.
46. Taylor CA, Cheng CP, Espinosa LA, Tang BT, Parker D, Herfkens RJ. In vivo quantification of blood flow and wall shear stress in the human abdominal aorta during lower limb exercise. Ann. Biomed. Eng. 2002; 30(3):402–8.
47. Reina M, Espel E. Role of LFA-1 and ICAM-1 in cancer. Cancers (Basel). 2017; 9(11).
48. Corcoran RB, Chabner BA. Application of cell-free DNA analysis to cancer treatment. N. Engl. J. Med. 2018; 379(18):1754–65.
49. Lemery S, Keegan P, Pazdur R. First FDA approval agnostic of cancer site — when a biomarker defines the indication. N. Engl. J. Med. 2017; 377(15):1409–12.
50. Heyde A, Reiter JG, Naxerova K, Nowak MA. Consecutive seeding and transfer of genetic diversity in metastasis. Proc. Natl. Acad. Sci. U. S. A. 2019; 116(28):14129–37.

2 thoughts on “L’attività fisica riduce il rischio di ricomparsa e mortalità nei pazienti con il cancro.”